中和点
概要
「中和点」とは、ずばり中和滴定が完了する瞬間のこと。もう少し丁寧にいえば、加えた酸の
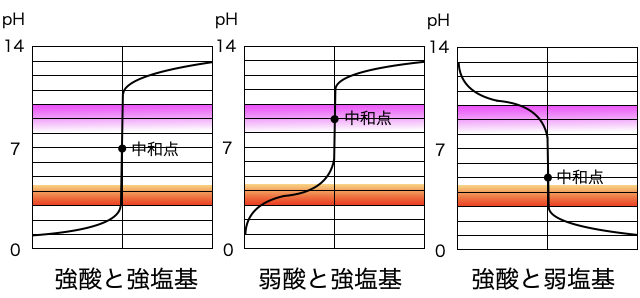
中和点は中性(25℃でpH=7)とは限りません。強酸と強塩基のときはpH=7ですが、弱酸と強塩基ならpH>7、強酸と弱塩基ならpH<7というように、強いもののpHに引っ張られたかのような値になります。
詳細
中性と中和点の違い
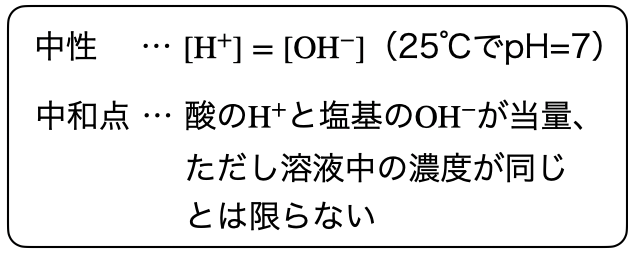
中和点では、滴定で使用する酸が持つ
中和点のpH
たとえば酢酸
理論的な話は「化学平衡で勉強する塩の加水分解」で勉強しましょう。ここではざっくり説明します。そもそも弱酸の
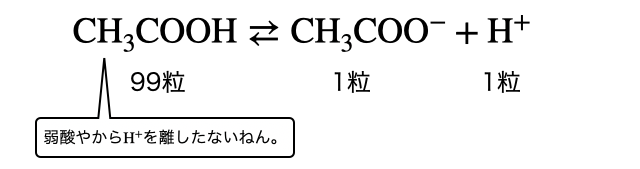
ここで、たとえば100粒の
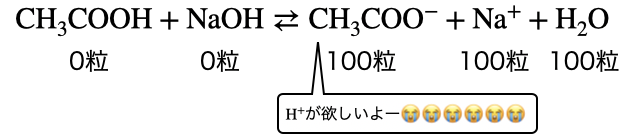
しかし先ほど言った通り、本来酢酸はあまり電離したくありません。それなのに100%
もちろん水自身もごくわずかしか電離したくないので(イオン積
以上、ぴったり中和した中和点なのに、加水分解が起こって
補足
- 100粒中1粒しか電離していない弱酸がなぜ中和反応で100%反応するかというと、電離平衡で常に一定数は電離するからです。1粒の
が中和されて0粒になってしまっては平衡が崩れるので、99粒の酢酸からまた1粒くらい電離します。するとその も途端に中和され、また0粒になってしまいます。すると残りの98粒からまた1粒くらい電離して、...、が繰り返されて結局全てが反応してしまいます。
この用語を含むファイル
関連動画






