pH指示薬
概要
「pH指示薬(酸塩基指示薬)」とは、特定のpHで色が変わる物質のこと。中和滴定の終点を決めるときなどに使われます。
詳細
pH指示薬
雑な話、たとえばもしも
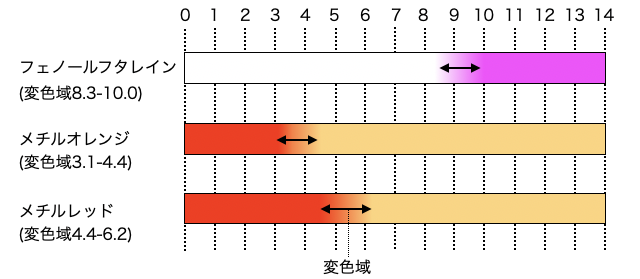
たとえばフェノールフタレインの変化は以下の通り。
受験レベルで覚えておきたいpH指示薬はフェノールフタレイン・メチルオレンジ・メチルレッドの3つです。変色域と一緒に覚えておきましょう。

中和点がわかる仕組み
変色域がpHジャンプ内にある指示薬を使えば中和点を観測できます。たとえば強酸と強塩基、弱酸と強塩基、強酸と弱塩基で中和滴定したときのpHと、フェノールフタレイン(PP)、メチルオレンジ(MO)の変色域は以下です。
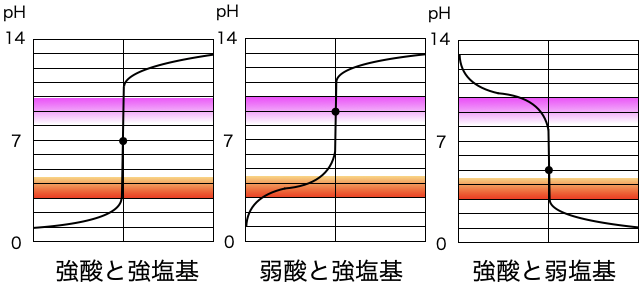
このグラフより、
- 強酸と強塩基ではどちらもOK
- 弱酸と強塩基ではPPのみ使える
- 強酸と弱塩基ではMOのみ使える
ことがわかります。
もしかしたら「強酸と強塩基の中和点はpH7なのに、変色域は約3〜5のメチルオレンジが使えるの?」みたいに思うかもしれませんね。でもこのように考えてみましょう。
たとえばビュレットからの1滴が0.050mLほどで、中和までに理論的には9.78mL必要だとしましょう。このときビュレットから195滴=9.75mL滴下し、次の1滴で9.80mLになって中和点を超えます。しかし中和点付近のpH変化は急激なので、この1滴でpHが大きく変化して変色域を通過します。
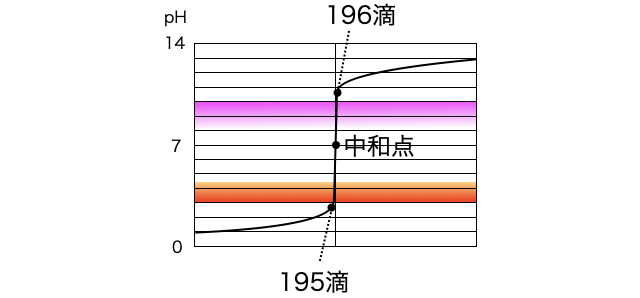
つまりこの中和に必要な滴下量は9.75〜9.80mLの間だと実験的にわかったわけです。あとは例えば有効数字2桁くらいの精度でよければ9.8mLで中和完了と考えることができます。
以上のように、ぴったり中和点のpHを測定せずとも、pHジャンプが発生したことさえわかればほぼ正確に中和点までの滴下量がわかる、ということです。
補足
- 中学で習ったBTB溶液(ブロモチモールブルー)も合わせて覚えておいて損はないです。
関連動画







