中和反応
概要
「中和反応」とは、ざっくりいうと酸と塩基が反応して水と塩を生じる反応のこと。中学校でも習う基本的な反応ですね。
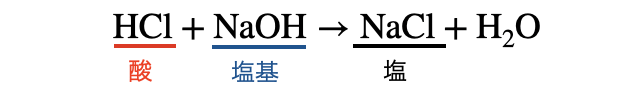
ただし「ブレンステンドの酸塩基の定義」で定義される酸塩基の中和反応では水が発生しない場合もあります。
詳細
中和反応
水溶液中で水は以下のように電離してます。
このとき、ざっくりいうなら100億粒に1粒くらいだけが電離しています。つまり水中で存在できる
水素イオン濃度
よって、
たとえばこの式が
反応式の作り方の基本
反応の仕組みを考えれば式を立てるのは簡単!先ほど言った通り反応の本質は水が発生する部分でした(*注1)。
つまり
(1)塩酸と水酸化ナトリウム
(2)硫酸と水酸化ナトリウム
つまりぴったり反応させるには、1粒の
(3)塩酸と水酸化カルシウム
つまりぴったり反応させるには、2粒の
複雑なパターン
補足にも少し書きましたが、これまではアレニウスの酸塩基に対する中和反応のみを扱いました。しかしブレンステンドの酸塩基が関わると一瞬反応式の作り方に困ってしまいます。ただしブレンステンドの酸塩基の場合は 「形式的に水を足す」 ことで先ほどとほぼ同じ方法で式を作れます。
(1)塩化水素とアンモニア
アンモニアに水を加えて電離させます。
あとは先ほど同様、
ただし両辺に水が被った場合は、最後に両辺から引き算をする必要があります。
(2)二酸化炭素と水酸化ナトリウム
二酸化炭素に水を加えて電離させます。
あとは先ほど同様。
最後に両辺から水を引き算。
(3)塩酸と酸化アルミニウム
酸化アルミニウムに水を加えます。実際には酸化アルミニウムは水に溶けませんが、反応式を作る手順として形式的に水を足します。
あとは同じ流れです。
あえて
最後に両辺から水を引き算。
補足
- 高校化学ではブレンステンドの定義をメインに使うはずですが、ここでは水中の
と に注目したアレニウスの定義っぽい説明の仕方をしました。わかりやすいのでまずはこちらで理解しましょう。それにこちらを理解すればブレンステンドの酸塩基もほぼ同じです。 ざっくりいえば、 が と結びつきやすいことで反応が起こるというのが上の説明でしたが、同じように が と結びつきやすいことで起こる のような反応がブレンステンドの酸塩基による中和反応です。詳しくは無機化学や理系の理論化学を勉強してからでOKです。 - (*注1)↑の通りアレニウムの定義的にはね。
この用語を含むファイル
関連動画






