酸
概要
「酸」とは、ずばり水素イオン
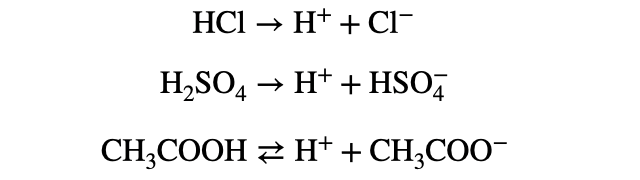
詳細
酸の定義
昔からなんとなく「金属とかをじゅわじゅわ溶かすのが酸」というイメージはあったでしょうが、ちゃんと酸を定義するのは簡単ではありません。
最初、酸と塩基は「アレニウスの定義」によって定義されました。しかしこれはアンモニア
そんな問題を解決すべく新しく「ブレンステッド・ローリーの定義」によって酸塩基が再定義されました。つまり、アレニウスの定義の方が中学理科以来馴染みがありますが、ブレンステッド・ローリーの定義の方が学問的にはより良い定義なのできっちり理解しておきましょう(*注1)。
それぞれの定義の具体的な内容は各ページで確認しましょう。
酸の種類
水溶液中でほぼ100%電離する酸を「強酸」、一部しか電離しない酸を「弱酸」といいます(*注2)。実はこの世の酸は原則弱酸で、強酸の方が珍しいです。授業でよく出てくる塩酸や硫酸が強酸なので強酸が普通なのかなーって思っちゃいますけどね。
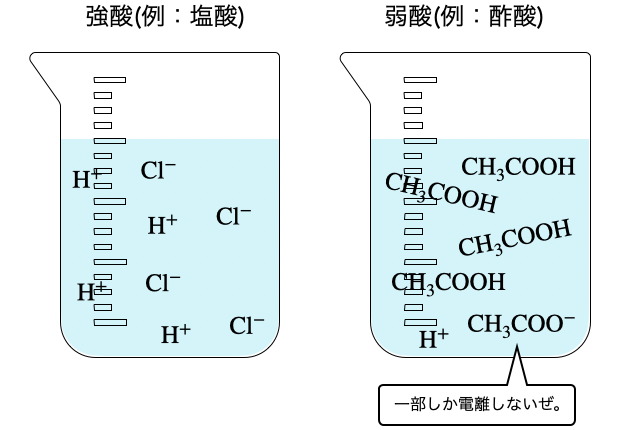
大学受験においては、酸が出てきたら原則は弱酸、例外的に塩酸
補足
- (*注1)とはいえ2つの定義の違いさえ理解していれば、アレニウスの定義っぽく考えた方がわかりやすい場合も多いです(中和滴定など)。両方の定義を使いこなせるようにするのがベターです。
- (*注2)たとえば弱酸である酢酸
は、濃度によりますがざっくり1%くらいしか電離しません。強酸と弱酸にはこのくらい差があると思っておくといいです。 - (*注3)もちろん高校レベルでも他に臭化水素
・ヨウ化水素 ・過塩素酸 など探せば他にも強酸はあります。しかし小難しいことは見なかったフリしておくのが受験を乗り切るコツです。
関連動画






