塩の加水分解
概要
「塩の加水分解」とは、塩が水に溶けて酸や塩基が発生する反応のこと。弱酸や弱塩基由来のイオンが、電離平衡の関係で水とくっついて
【例】
塩の加水分解によって、弱酸のイオンからは
- 強酸+強塩基の塩は、中性(例:
) - 弱酸+強塩基の塩は、塩基性(例:
) - 強酸+弱塩基の塩は、酸性(例:
) - 弱酸+弱塩基の塩は、弱酸と弱塩基の種類次第
詳細
仕組み
弱酸+強塩基の場合も、強酸+弱塩基の場合も、仕組みは同じです。だから今回は、弱酸+強塩基の例である
100粒の
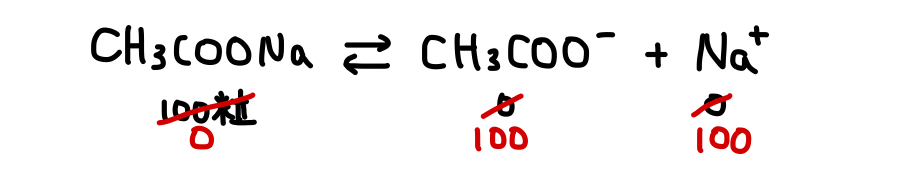
本来、たとえば100粒の酢酸
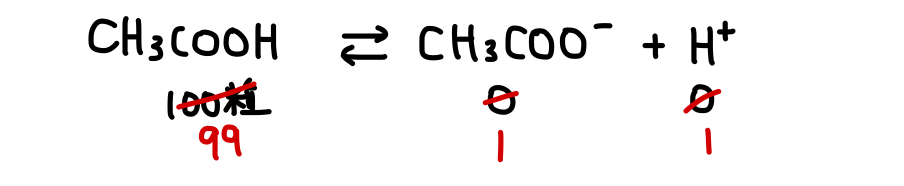
それなのに
これを踏まえて水溶液中をみると、溶媒である水が、
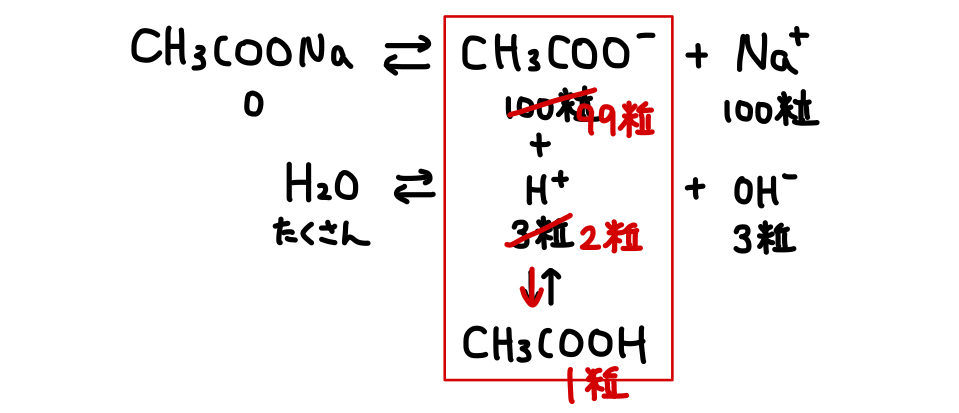
以上の反応の結果をまとめると、
pHの計算(弱酸+強塩基の例)
たとえば、弱酸
塩の加水分解によるpHの計算は2ステップ。
- 反応の量的関係から、
や を電離定数で表す。 - 加水分解の電離定数を、弱酸(弱塩基)の電離定数
( )や水のイオン積 で表す。
です。今回も、
まずはステップ1。もし電離定数を定義するなら、
これを踏まえて、弱酸のpHを求めるとき同様、反応が起こっていない場合の
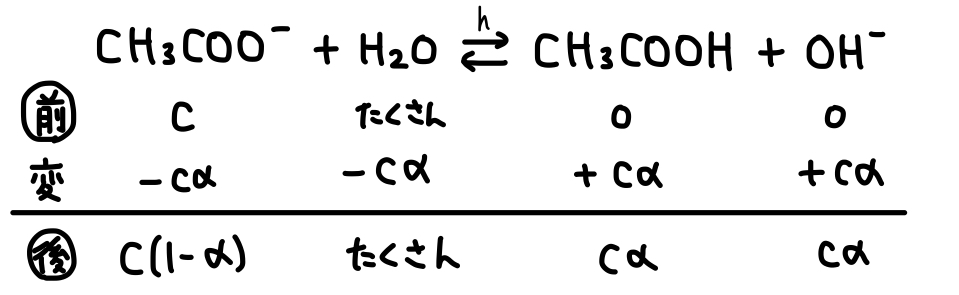
よって、
続いてステップ2。実は
ここからの変形はかなりトリッキーなので、お決まりの手順として覚えてしまいましょう。
これにより、
補足
- (*補足1)イメージのしやすさのため「粒」で数えていますが、電離定数は本来「濃度」で定義されていることに注意。
- (*補足2)もし
のような反応で、 の場合、2つを掛け算すると、 となって、2段階の反応をまとめた反応 の電離定数になります。また、たとえば のような逆反応の電離定数は、 となります。以上を踏まえると「塩の加水分解は、水の電離+弱酸電離の逆反応」だから、 となりそうです。実際、 と定義に一致しています。
この用語を含むファイル
関連動画








