加水分解
概要
「加水分解」とは、水
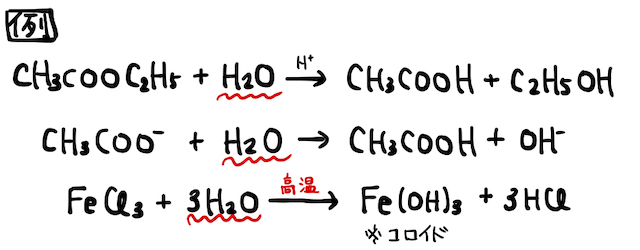
単に加水分解と覚えても特に理解は深まらないので、
など、仕組みに基づいて個別に理解しておきましょう。
詳細
(1) 塩の加水分解
弱酸由来の塩(*補足1)は、水溶液中で加水分解を起こして弱塩基性を示します。同様に、弱塩基由来の塩は弱酸性を示します。
弱酸由来の塩
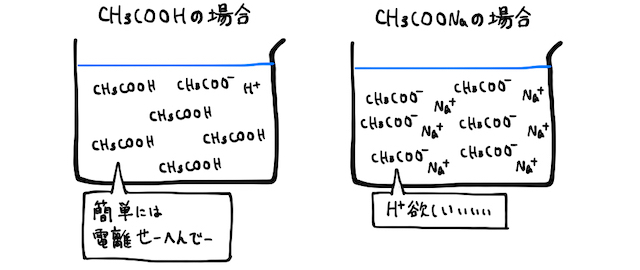
一瞬話はそれますが、そんなところに強酸を加えて大量の
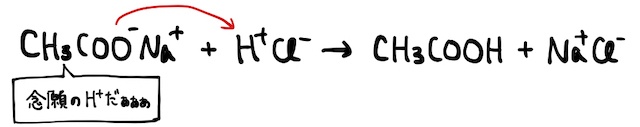
話を戻します。ただの水溶液中でも、水がほんの一部電離することでほんの少し
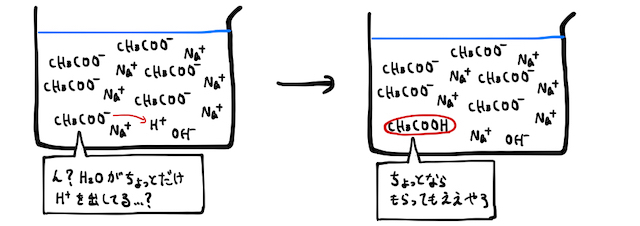
以上をまとめるなら、弱酸由来の塩
ちなみに弱塩基の場合も考え方は同じです。より詳しい仕組みや数式的な理解は、「[塩の加水分解]」の辞書を確認しておきましょう。
(2) エステルの加水分解
有機化学で勉強するエステルは、カルボン酸とアルコールが脱水縮合したものです。超ざっくり説明するなら、カルボン酸の
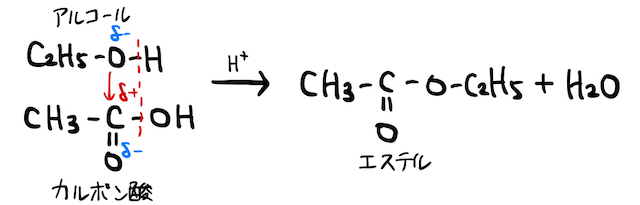
一方、以上の結果生じるエステルと水も、それぞれ
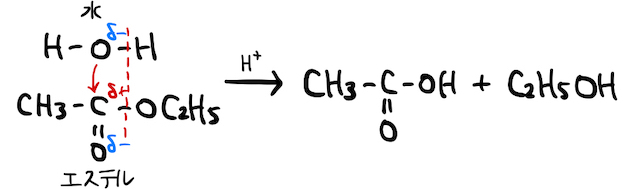
より詳しい仕組みや数式的な理解は、「エステルの加水分解」の辞書を確認しておきましょう。
(3) その他
反応の仕組みは関係なく、とにかく結果的に水が足されて分解していれば加水分解と呼ばれます。参考書で「これは加水分解です」と言われても、特に深読みせず「水が足されるんやなあ」と思っておけばOKです。
たとえば、不安定な塩化ベンゼンジアゾニウムを約5℃以上にすると、以下のような加水分解反応が起こります。
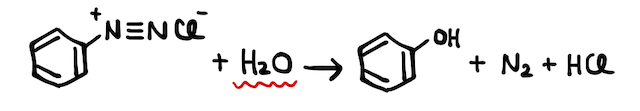
またスニーカー好きの方は「スニーカーが加水分解する」みたいな話を聞いたことがあるかもしれません。スニーカーのソールには、縮合重合(脱水してたくさん結合すること)による高分子であるポリウレタンなどが使われています。脱水してできたポリウレタンは、逆に水と反応して分解反応を起こしてしまい、ソール部分が剥がれるなどの劣化が起こるわけです。
以上、加水分解の仕組みは様々あるので、詳しく理解したい人は個別に仕組みを理解しましょう。
補足
- (*補足1)まず「塩」とは、ざっくり言えばイオン結晶のことです。イオン結晶は陽イオンと陰イオンからなり、そこに注目するとどんな酸と塩基が中和すればできるかがわかります。
たとえば、
は と からなります。元々どちらも酸か塩基だったとするなら、陰イオン は陽イオン を捨てた形、陽イオン は陰イオン を捨てた形、と捉えることができます。よって、 は弱酸と強塩基に由来する、と言えるわけです。
関連動画






