中和滴定
概要
「中和滴定」とは、中和滴定を利用してわからない濃度やモルを測定する方法のこと。中和反応がぴったり起こると (酸の
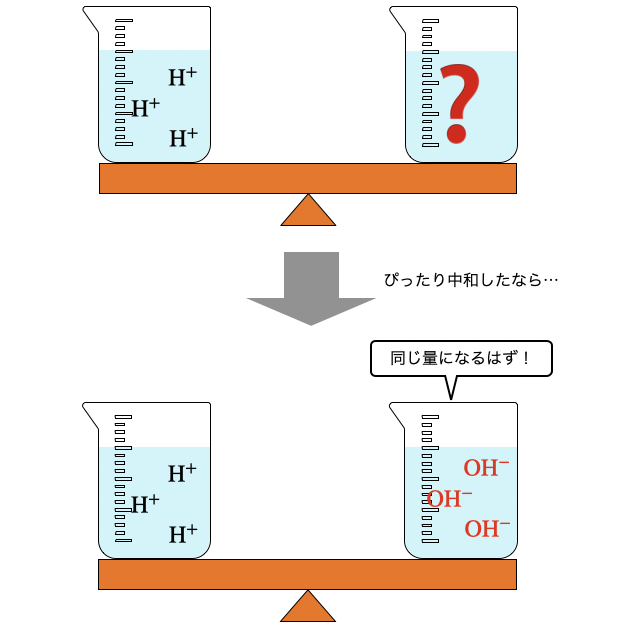
目盛りの刻まれた物差しを用意すれば、長さ不明の物体の長さが測れますね。どうように、濃度・体積を正確に測った酸や塩基を用意して、それとぴったり中和した濃度不明の酸や塩基の量を測るのが中和滴定です。
入試問題では、中和滴定の実験データから未知の濃度やモルを計算する問題の他、実験器具の取り扱いについても問われます。
詳細
中和滴定の計算
中和滴定の計算は至って簡単です。たとえば濃度不明の塩酸
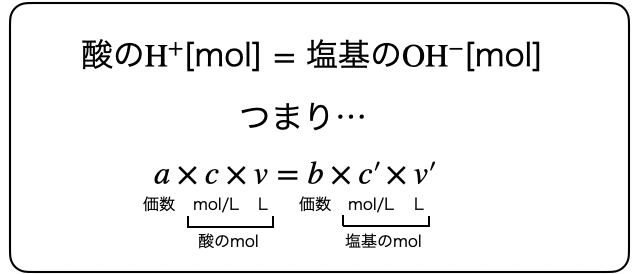
一応公式っぽく書いときましたが、数を数えるだけなので公式を覚えるより (酸の

酸の
1粒の
次に、1粒の
これらがぴったり中和したので、
このように、酸の
実験器具の取り扱い
滴定に用いる実験器具・薬品には主に、
- ホールピペット
- メスフラスコ
- コニカルビーカー
- ビュレット
- pH指示薬(酸塩基指示薬)
があります。それぞれの使い方と洗い方を注意して理解しましょう。
- メスフラスコ
メスフラスコは、正確な濃度の溶液を作るための器具で、体積を正確に測ることができます。たとえば、1Lをぴったり測れるメスフラスコに固体のシュウ酸(分子量90)を9g(=0.10mol)入れ、1Lのラインまで純水を入れて溶かせば0.10mol/Lのシュウ酸水溶液が作れます。
どうせ結局1Lになるまで純水をドバドバ入れるので、メスフラスコ内部は水で濡れていても問題ないため純水で洗います。
- ホールピペット
ホールピペットは、薬品を10mL、20mL、...など、決まった量だけ正確に測りとるための器具です。メスフラスコで作った濃度が正確な溶液をホールピペットで測り取れば、濃度も体積も正確な薬品を取ってくることができます。
仮にホールピペットの中が水で濡れていれば濃度が薄まってしまいます。そこでホールピペットは共洗いをする必要があります(*注3)。
- コニカルビーカー
クラスに1人は「俺、テストでコミカルビーカーって書いちゃったわーwwwww」とクソ寒いこと言い出すことでおなじみのコニカルビーカー。コニカルビーカーは、濃度不明の薬品を入れておき、上から薬品が降ってきて中和されるのを待つ、いわば処刑台的なビーカーです。普通のビーカーよりも円錐っぽくなっていて、ビーカーを振るだけで中身が混ざりやすくなっています。
コニカルビーカーは純水で洗います。なぜなら、中和滴定で測ることができるのは「
- ビュレット
ビュレットは、液体を上から滴下するのに使う器具で、滴下した体積がわかるように目盛りがついています。中和滴定の処刑執行人です。
ビュレットは共洗いをする必要があります。たとえば、0.10mol/Lの塩酸を入れて10mLで滴定が完了したとします。でも実はビュレットが水で濡れていて濃度が薄まり、ビュレット内の塩酸が0.09mol/Lになっていたとしましょう。すると計算上は、
の
しか入っていなかったことになり、計算がずれてしまいます。よって純水で洗わずに共洗いをする必要があります。
- pH指示薬(酸塩基指示薬)
中和がぴったり完了する瞬間を見極める薬品が「pH指示薬(酸塩基指示薬)」です。早い話が、pH指示薬の色が変わった瞬間が(酸の
特殊な滴定法
中和滴定をしたい相手によって、「逆滴定」「二段滴定」などを行う場合もあります。詳しくはそれぞれのページをチェック!
補足
- 実験器具については物理屋チャンネル/naoさん・ただよび理系チャンネルさん・Nagira Academyさんなどの動画もチェック!
- (*注1)弱酸や弱塩基は水中で一部しか電離しませんが、中和反応が起こると最終的に100%電離して最後まで反応が進みます。その理由は「電離平衡」や「ルシャトリエの原理」を勉強してから考えてみましょう。
- (*注2)中和滴定の計算は簡単ですが、実験の都合で行う濃度の調整などが複雑です。詳しくは受験メモ山本などの動画もチェック!
- (*注3)使う薬品で洗うのが共洗いです。洗ったばかりの濡れたコップにオレンジジュースを入れると少し薄まってしまって嫌ですが、コップをオレンジジュースで洗っておけば濡れた水滴自体もオレンジジュースだから薄まらずに済む、というイメージです。
関連動画






