カルボン酸
概要
「カルボン酸」とは、カルボキシ基
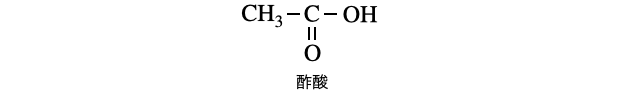
酢酸のイメージから分かる通り、カルボン酸は、
また、酢酸ナトリウムと固体の水酸化ナトリウムを加熱してメタンを発生する反応は、実験室のメタンの製法として大学入試では頻出です。難しい言葉では脱炭酸反応と呼びますが、反応の名前はそんな覚えなくていいです。
詳細
カルボン酸の種類
カルボン酸は慣用名で呼ばれるものが多いです。一応大学入試向けに名前を覚えておきたいカルボン酸を以下にまとめますが、最低限「ギ酸」と「酢酸」を覚えて後は問題で出てきたときに覚えていけば十分です。
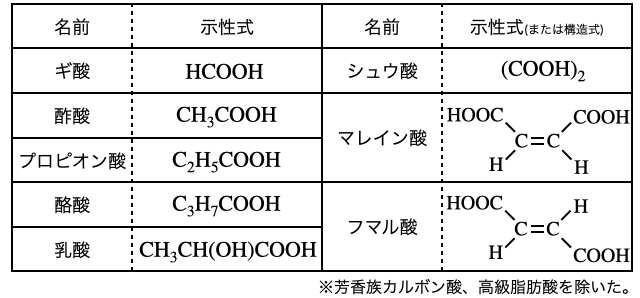
ちなみにギ酸を漢字で書くと「蟻酸」で、蟻に含まれることから名前が付けられました。蟻酸って書くと「ありさん」とも読めるからギ酸ってちょっとかわいいですよね(?)。
物理的性質
カルボキシ基
また、カルボン酸は
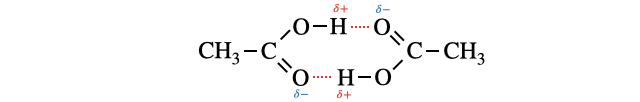
二量体は、二量体を作るのに水素結合を使い切っているので、水和がしにくく水に溶けにくいです(*注1)。
化学的性質
カルボキシ基
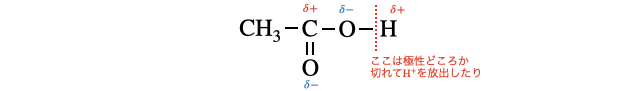
その結果、
①酸としての反応
化学基礎から弱酸として酢酸を扱ってきたように、カルボン酸は以下のように電離して酸として働きます(*注2)。
つまり、理論化学や無機化学で習った酸の反応を起こします。
【例1:中和反応】
【例2:弱酸遊離反応】
②エステル化
カルボン酸とアルコールが脱水してくっつく反応を「エステル化」といいます。詳しい反応の仕組みは上のリンク先をチェック!
③脱水反応
2つの
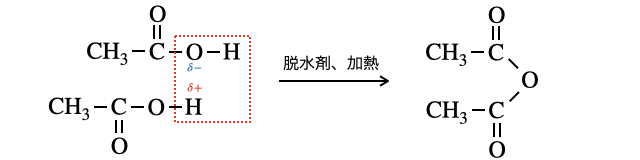
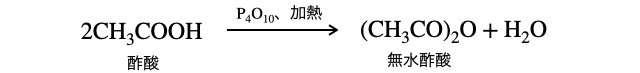
【例1:酢酸】
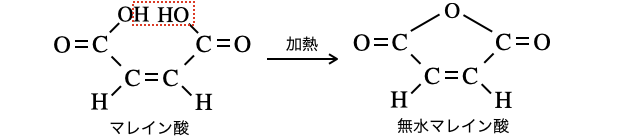
【例2:マレイン酸】
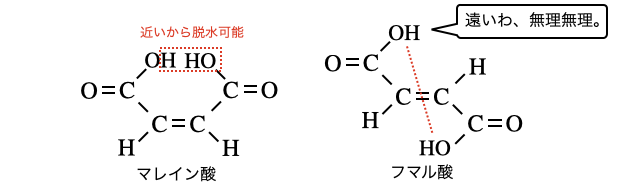
ちなみに似た構造のジカルボン酸であるフマル酸は、2つの
④脱炭酸反応
最後に少しだけマニアックな反応を紹介します。登場頻度は低いので余裕がある人だけでOKです。実はカルボン酸イオン
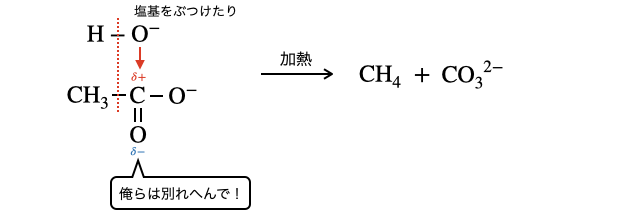
より具体的な反応としては、酢酸ナトリウムに固体の水酸化ナトリウムを加えて加熱するものなどがあります。
無理やり加熱して起こす反応だからなかなか生成物のイメージは難しいですが、
補足
- (*注1)エステル化の実験などで材料のカルボン酸と生成物のエステルを分離するとき、水層にカルボン酸、有機層にエステルを溶かして分離しますが、一部のカルボン酸は二量体となって有機層に混ざってしまうことがあります。
- (*注2)カルボン酸は弱酸の中では比較的強い酸で、有機化学で他に登場する炭酸やフェノールなどより強めの弱酸です。理由は大学レベルなのでざっくりだけ言っておくと、カルボン酸が電離した
は、ベンゼンが「1.5重結合」で安定になったのと同じことが起こります。電離後の構造が安定だから、電離が比較的進みやすいと言うことです。もっと詳しく知りたい場合は「非局在化」をチェック。
関連動画
関連用語




