アルカン
概要
「アルカン」とは、炭素
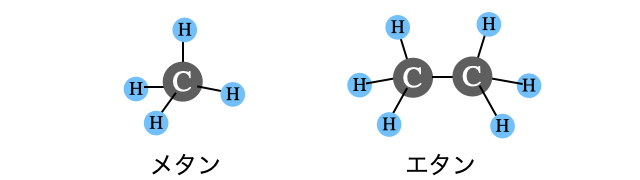
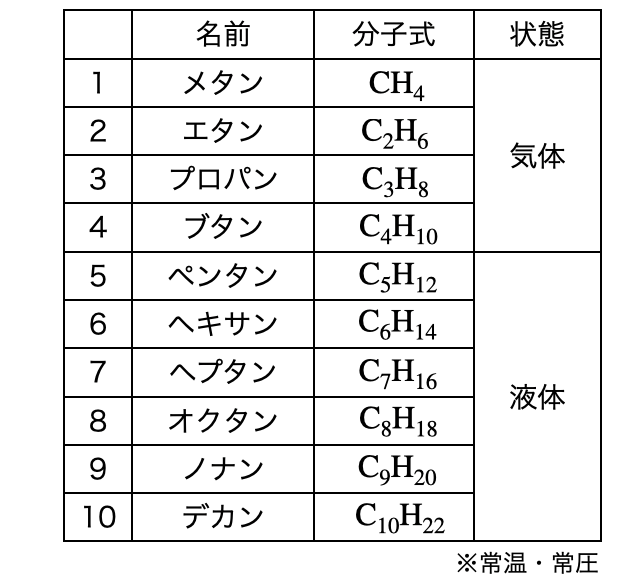
炭素数が
ちなみにメタンやエタン、プロパンなどは料理するときなどに使うガスに、ブタンはライターやカセットコンロの燃料などに使われています。
アルカンは極性が小さい分子なため、融点・沸点が低く(=気体になりやすく)、水に溶けにくいです。また極性の小さく硬い単結合(共有結合)でできているため反応性も低いです(*注2)。ただし、酸素と着火して起こる燃焼反応、ハロゲンを加えて光を照射して起こるハロゲン化反応など、外からエネルギーを加えれば起こる反応もあります。
詳細
アルカンとは
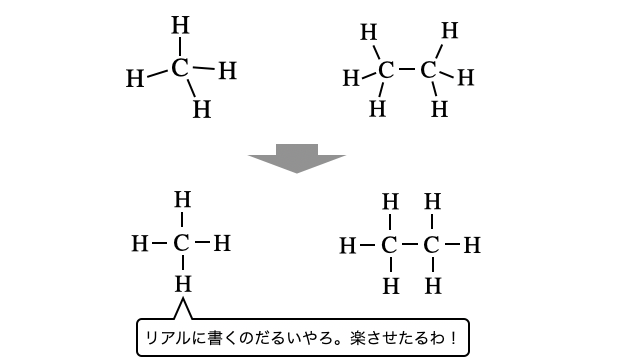
アルカンは、単結合のみからなる鎖式炭化水素です。各炭素原子から伸びる4つの単結合は、メタンの構造と同様に正四面体の頂点方向へ伸びるので、アルカンはギザギザとした構造になります。しかし見やすさの問題で教科書にはまっすぐ書かれることが多いです。
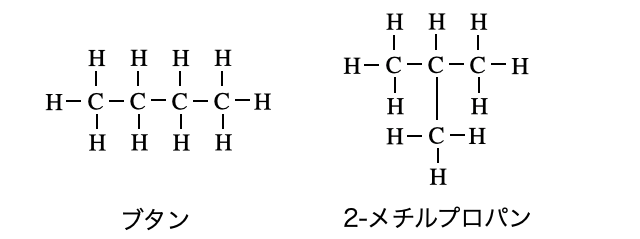
また、アルカンに限った話ではないですが、炭素数が多い有機化合物は炭素のつながり方によって「異性体」が存在します。たとえば単にブタン
アルカンは天然ガスや原油に多く含まれており、原油は蒸留によって炭素数ごとに分離されます。地面に埋まったガス管から送られる都市ガスの原料は天然ガスで、主成分はメタンとエタンです。一方、家の側に置かれがちなデカいボンベに入ったLPガスは、石油由来のプロパンやブタンが主成分です。稀に問われる知識なので、ふわっと覚えておきましょう。
物理的性質
電気陰性度の差が小さい炭素と水素のみからなるアルカンは、極性が小さいため融点・沸点が比較的低く、水に溶けにくいです。分子量が大きい分子ほど分子間力が大きくなるので、炭素数が増えるほど融点・沸点が高くなります。25℃・1気圧で炭素数1〜4までは気体、5〜17は液体、18以上は固体となります(*注3)。
化学的性質
電気陰性度が大きい非金属元素同士が作る硬い共有結合のみからなるため、アルカンは反応性が低いです。ただし、硬い結合を切るようなエネルギーが加えられれば化学反応を起こします。大学受験としては以下のうち①②を覚えておきましょう。
① 燃焼反応
酸素を加えて着火することで、熱を発しながら燃える反応です。まあ普通に化学基礎でも出てくる反応ですね。
② ハロゲン化反応
大学受験では反応の結果だけわかればいいですが、覚えやすさのために少し踏み込んで反応の仕組みと合わせて説明しておきます。
ハロゲン分子に光や熱によってエネルギーを与えると、一瞬共有結合が切れて2粒の原子になります。原子状態になるなんて、いとえねるぎー高き様なり。このように不対電子を持つ物質を専門的にはラジカルと言います(暗記の必要はなし)。
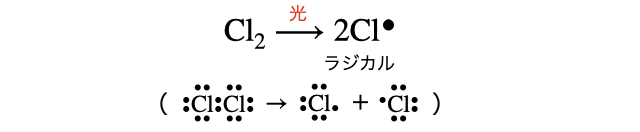
エネルギーを押し付けられて一時的には不安定な原子状態になりましたが、もちろんなる早(*注4)で結合を作って安定化したいです。そこで近くにいるアルカンに攻撃を仕掛けます。
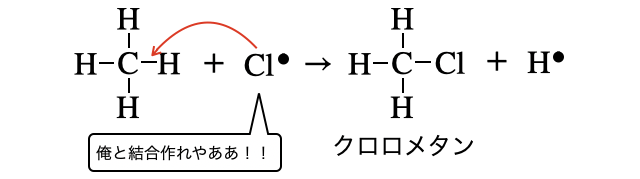
そして、仮に以上の2つを足し算したなら、以下のような反応が起こったと言えそうです。これがハロゲン化反応です。
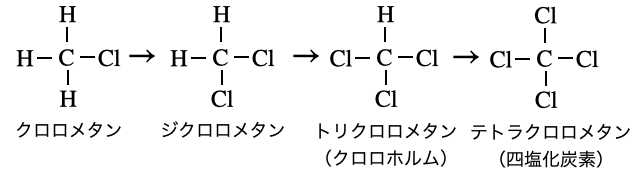
ただし、実際にはラジカルは手当たり次第ランダムに攻撃を仕掛けるので、
③ 熱分解反応(接触分解)
これは大学受験ではあまり登場しないので気になる人向けです。炭素数の大きなアルカンに熱と触媒を与えることで、無理やり
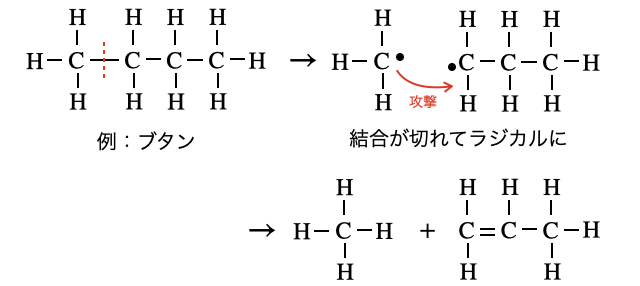
(反応の段階を省略しているのであくまでイメージです。)
原油からはさまざまな炭素数のアルカンが得られますが、炭素数が大きすぎるアルカンは用途が限られます。そこで熱分解により使いやすいサイズのアルカンを得たりしています。
補足
- (*注1)「アルミ缶の上にあるみかん」と同じノリで「アルカンの上にある缶」というダジャレを思いついたので使ってください。
- (*注2)反応性が低いとは、中和や酸化還元のように混ぜたら簡単に反応したりしない、というイメージ。アルカンを他の物質とただ混ぜても反応が起こりづらいですが、火花を当てるなど大きなエネルギーを与えれば化学反応自体はもちろん起こります。
- (*注3)炭素数14、15、16、17のアルカンの融点は順に6℃、9.9℃、18℃、21℃(wikiより)なので、この辺りはちょっと冷やせばすぐ固体になります。
- (*注4)「なるべく早く」の略。英語でAs soon as possible.をASAPというのと同じ。
- 実験室でのメタンの製法については「カルボン酸」の記事を参照のこと。
関連動画
関連用語




