置換反応
概要
「置換反応」とは、有機化合物中の原子たちが別の原子たちに置き換わる反応のこと。
多重結合に別の分子が追加でくっつく付加反応と違い、結合が切れて官能基が丸ごと置き換わります。
詳細
構造式の見た目上、官能基が入れ替わっていれば置換反応ですが、反応が起こる仕組みはいろいろです。
1. アルカンの置換反応
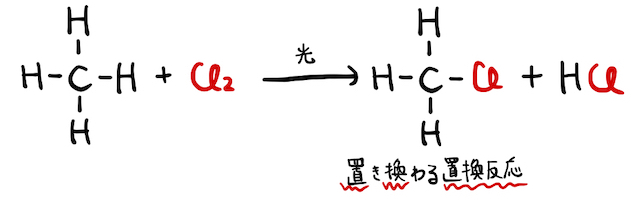
アルカンに光を照射しながら塩素
反応の詳しい仕組みは以下の通り。一般に、分子を作る共有結合は硬い結合なので、ぶった斬るにはそれなりの理由が必要です。ここで、実は塩素
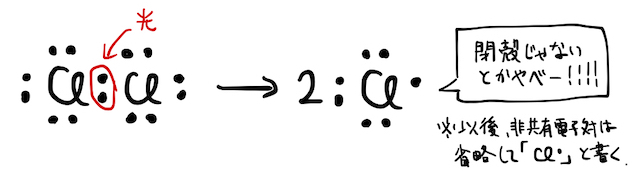
もちろん、最外殻電子が7個の激ヤバ状態はかなり不安定で、周囲の電子に攻撃を仕掛けます。たとえばメタンを
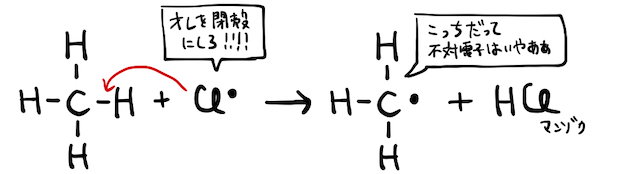
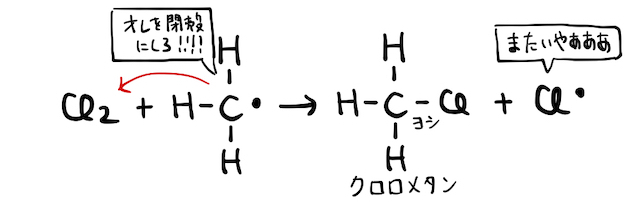
ただし、以上の反応では最後にもう一度塩素原子が発生しています。これにより、この反応は連鎖的に発生することになります。玉突き事故的な感じです。
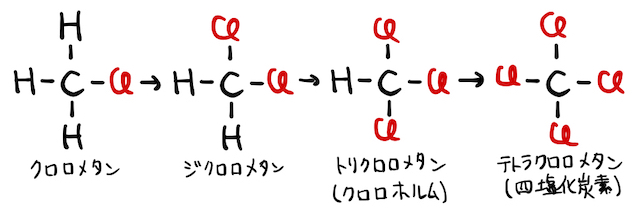
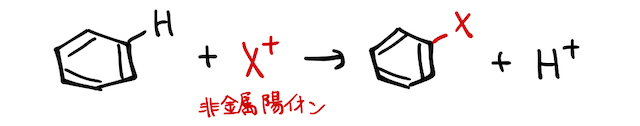
2. ベンゼンの置換反応
ベンゼン環に特定の陽イオンをぶつけると、以下のような置換反応が起こります。
ベンゼン環はたくさんの二重結合を持つので一見付加反応を起こしそうですが、非局在化によって安定化しているベンゼン環が破壊される反応は起こりにくいです。
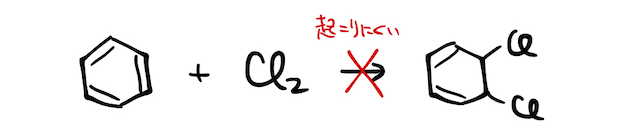
とはいえ、ベンゼン環にはたくさんの二重結合があって電子が密集しているのは確かです。そんなところに非金属元素の陽イオン
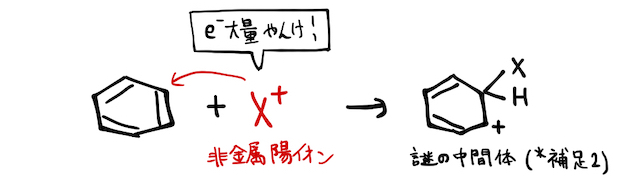
これでは結合の状態がおかしいですが、安定なベンゼン環が壊れない形で辻褄が合うように、水素
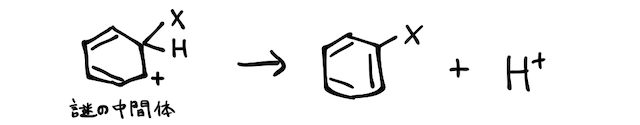
以上がベンゼンへの置換反応の主な仕組みです。では、具体的にどんな物質が反応するのかを見ていきましょう。
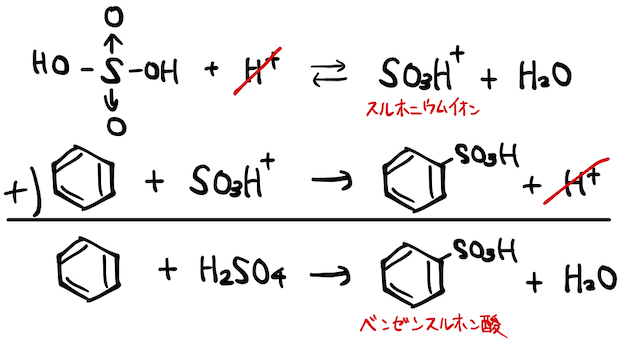
(i) 濃硝酸
硫酸
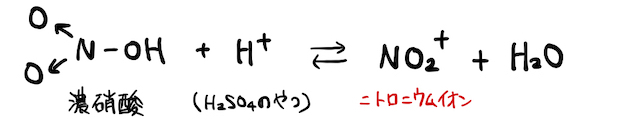
こんなイオン見たことないことから察すると思いますが、もちろんこいつは不安定で化学平衡的にちょっと発生するイメージです。しかしその周りに電子を豊富に持ったベンゼン環がいれば、非金属陽イオンの
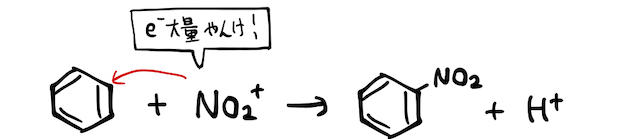
以上を合わせれば、以下のような反応式になります。濃硫酸は1つ目の反応で
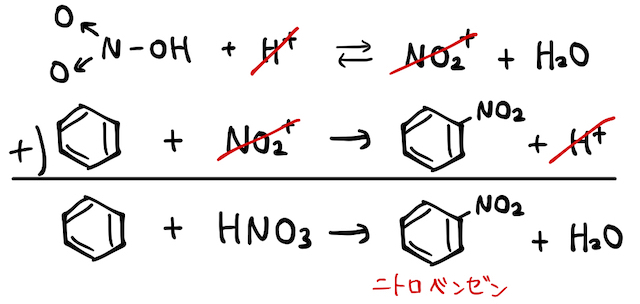
(ii) 濃硫酸
濃硫酸
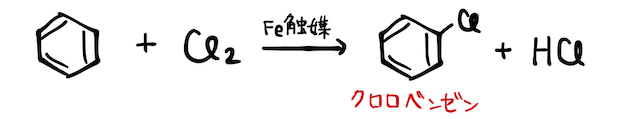
(iii) ハロゲン(+鉄触媒)
塩素
によって、クロロニウムイオン
(iv) その他
ここまでが大学入試の基本として暗記必須の反応です。ただし、その後の細かな反応の中で似た仕組みが登場することがあります。
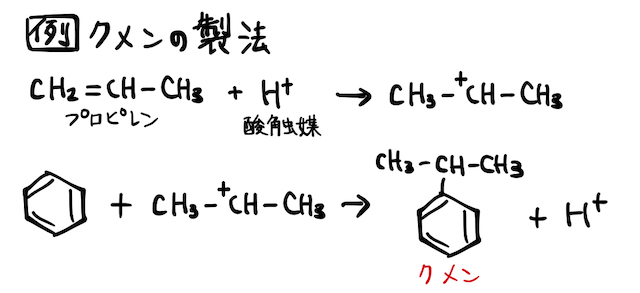
正直、ここまで仕組みを考えずとも(i)〜(iii)の反応式だけ丸暗記でも問題ありませんが、仕組みを知っているとこのようなときに同じ反応として理解が楽になりますね。
3. その他
あえて置換反応と呼ぶことは少ないですが、たとえばエステル化なども置換反応の1つと考えることができます。そう考えると定義上の置換反応は莫大にありそうです。
補足
- (*補足1)このように、不対電子を持った原子や分子の状態を「ラジカル(https://dic.okedou.app/words/p/BzgRuLfsmNmrz)」といいます。
- (*補足2)二重結合中の2電子を使って
が結合を作り、代わりに二重結合が単結合になります。ただし、この2電子は2粒の炭素原子が1粒ずつ持ち合ったものなので、図の下側の炭素が1電子を奪われた形になり陽イオン状態になっています。 - (*補足3)たまに「濃硫酸は弱酸」と説明されることがありますが、本質的にやはり濃硫酸は強い酸と捉えてOKです。通常の酸は
を水 に渡し(水和し)、オキソニウムイオン を作ることで酸性を示します。一方、濃硫酸は約98%ほどの濃度でほとんど水分子を持たないので、他の強酸ほど を作れません。この意味で「濃硫酸は(アレニウスの定義からすると)弱酸」と説明されることもあります。 しかし、水を加えて希硫酸にすれば電離しまくることからわかるように、濃硫酸は水がないから電離していないだけで、本質的に電離する能力自体は持っています。つまり、 を他の物質に渡す潜在的能力はかなり大きいです。アレニウスの定義から電離した で判断すると弱酸のように見えますが、ブレンステッドの定義から を受け渡す能力で判断すると強酸で、後者の方が本質的だということです。 以下蛇足ですが、濃硫酸のような溶液の酸性度合いを数値化するために定義されたものに「ハメットの酸度定数」があります。濃硫酸のような濃厚溶液は、pHでは適切に測れないということですね。 - (*補足4)ハロゲン化鉄(III)
の他に、単に 鉄 を触媒としてもOKです。鉄とハロゲンが酸化還元反応を起こして となることで、結局同じことになります。
関連動画






