ベンゼン
概要
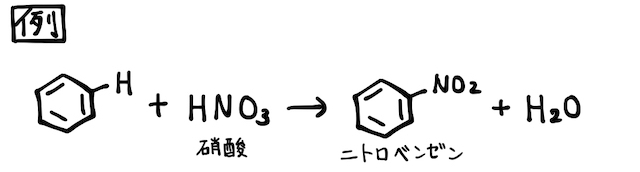
「ベンゼン」とは、分子式
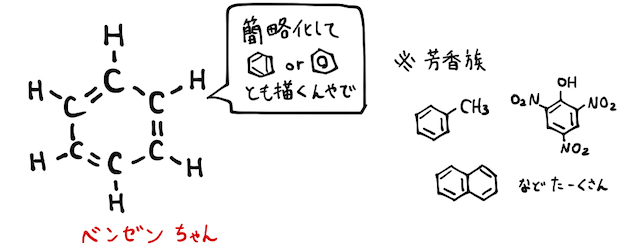
ベンゼンはこの書き方だと、3個の単結合+3個の二重結合からなるように見えますが、実際には「非局在化」が起こることでいわゆる"6個の1.5重結合"のような状態になっています。これによってベンゼン環は比較的安定な分子になっています。
通常、二重結合には付加反応が起こりやすいですが、非局在化で安定化しているベンゼンは置換反応の方が起こりやすいです。その他、特別に条件を整えれば付加反応や酸化開裂も起こります。
詳細
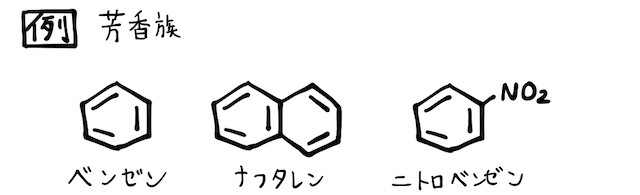
ベンゼンとは
ベンゼンは分子式
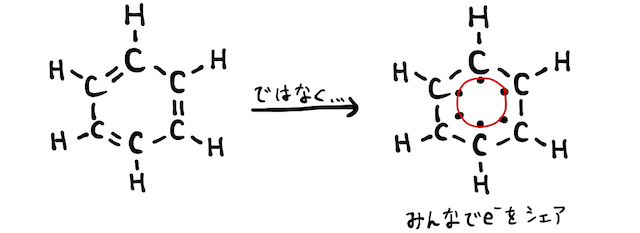
ベンゼンは、簡易的には3個の単結合+3個の二重結合からなる構造で描きます。しかし実際は、余った6個の電子を六角形全体で共有します。これを「非局在化」と言います。
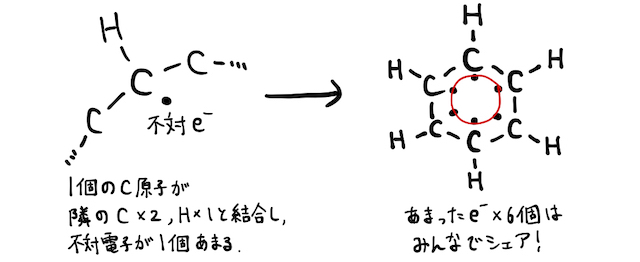
この話は高校レベルを少し離れているので、より深く知りたい人は「非局在化」の方で確認してみてください。要点だけまとめれば、ベンゼンは非局在化によって、
- 6個の結合の区別がなくなる
- 3個の単結合+3個の二重結合より安定化する
ということを覚えておきましょう。前者の性質により、ベンゼン環が歪みのない綺麗な正六角形になったり、2置換体の異性体がオルト・メタ・パラの3種類になります(詳しくは「異性体」で)。また後者の性質により、付加反応よりも置換反応が起こりやすくなります。
ベンゼンの反応
(1) 置換反応
ベンゼン環は安定なので、ベンゼン環自体が破壊される反応は比較的起こりづらいです。代わりに、ベンゼン環を維持したままの「置換反応」を起こせます。
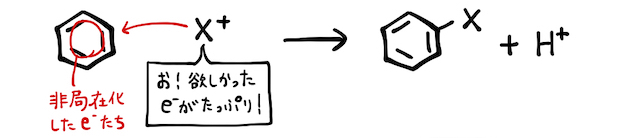
簡単に反応の仕組みを説明します。ベンゼン環には、非局在化によりマイナスの電子が集まっています。そこを狙って、電子好き陽イオンが攻撃を仕掛けます。しかしベンゼン環は安定なので、環構造が壊れることはなく
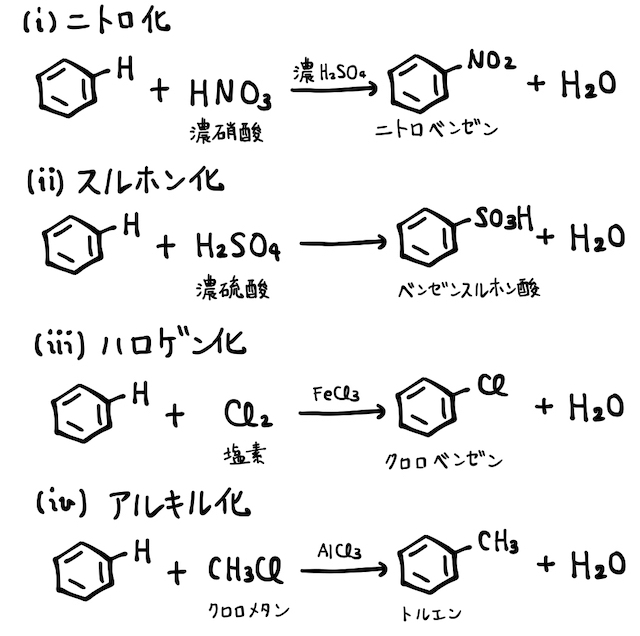
これが基本の仕組みです。たとえば硝酸
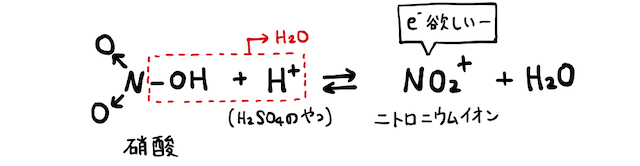
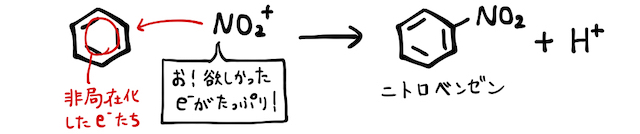
似た仕組みでニトロ化、スルホン化、ハロゲン化、アルキル化などが起こります。詳しくは「置換反応」を確認しておきましょう。
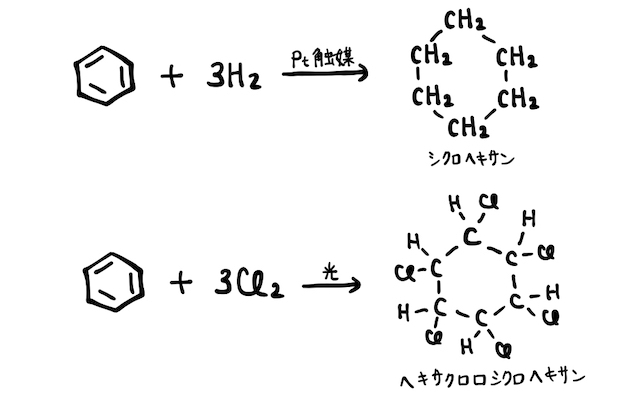
(2) 付加反応
ベンゼン環では原則置換反応が起こりやすいですが、特別な理由があれば付加反応を起こすことができます。たとえば、
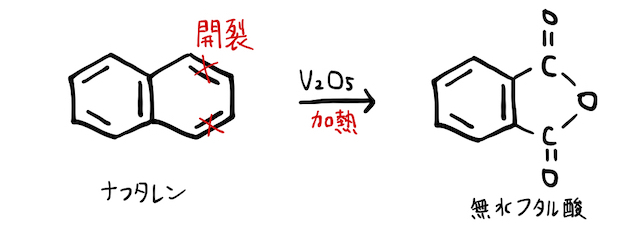
(3) 酸化開裂
ベンゼン環は、
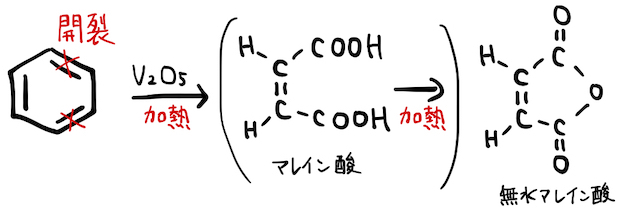
と
ベンゼンの製法
自然界でベンゼンは、石油や石炭などの炭素を多く含む物質中に混在することが多いです。人工的にベンゼンを作る方法の一つに、アセチレン3分子の付加重合があります。
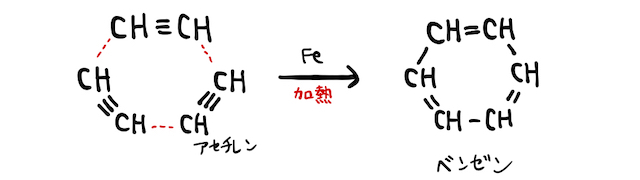
具体的には、赤熱した鉄管(鉄触媒)中にアセチレンガスを通すことで作られます。問題文中にこの工程も登場することがあるので、余裕があれば頭に入れておきましょう。
補足
- (*補足1)スペース的に省略しましたが、ナフタレンの酸化開裂も頻出です。マレイン酸もフタル酸も、分子内の近い位置に-COOHが隣接しているので、加熱した勢いで無水物になっています。
関連動画






