芳香族求電子置換反応
概要
「芳香族求電子置換反応」とは、電子を豊富に持つプラスの物質が攻撃して起こる置換反応のこと。マイナスめがけてプラスが攻撃するという、とてもわかりやすい反応です。

高校化学で登場するベンゼンの反応で、
- ニトロ化
- スルホン化
- ハロゲン化
- アルキル化
- ジアゾカップリング
など、多くの反応が芳香族求電子置換反応です。
詳細
反応の仕組み
電子を求めて化学反応を起こそうとする物質を「求電子剤」と言います。たとえば、なりたくて陽イオンになる
ベンゼン環にはπ電子が多く存在するので、求電子剤を加えるとベンゼン環に結合を作ります。

この形は不安定ですが、ベンゼンは非局在化により安定化しているので、ベンゼン環が破壊されることはありません。となると結局求電子剤が外れるか水素

このように、求電子剤によって起こった置換反応が芳香族求電子置換反応です。水素が外れることに関して感覚的に説明するなら、水素はよく
化学平衡で使うようなエネルギー図で見ると、実際以下のように

求電子剤の発生
(1)ニトロニウムイオン
濃硝酸

酸触媒としては主に濃硫酸を使い、濃硝酸と濃硫酸を混ぜたものを「混酸」といいます。ニトロ化では、混酸中のニトロニウムイオンが芳香族求電子置換反応を起こしている、と言えるわけです。
(2)スルホニウムイオン
濃硫酸
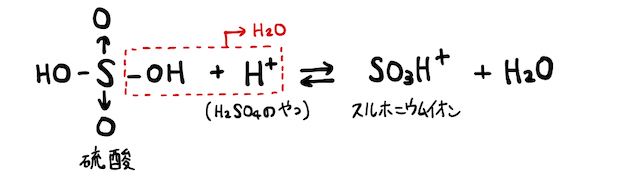
(3)クロロニウムイオン
塩素

(4)塩化ベンゼンジアゾニウム
「ジアゾ化」で勉強するように、アニリンに亜硝酸ナトリウムと塩酸を加えることで、塩化ベンゼンジアゾニウムが発生します。

これがナトリウムフェノキシドに攻撃することで、カップリング反応が起こります。
位置選択性
ベンゼンに官能基が1つ置換する場合、6ヶ所のどこに置換するかはわかりません。しかし、ベンゼンが官能基を持つ場合、官能基の種類によって置換反応が起こりやすい位置が異なります。フェノールやアニリンなどのように、オルト-パラ位で起こりやすい性質を「オルト-パラ配向性」といいます。一方、ニトロベンゼンのように、メタ位で起こりやすい性質を「メタ配向性」といいます。

詳しい仕組みなどは「配向性」を確認してみましょう。
この用語を含むファイル
関連動画






