概要
「アルカリ融解」とはずばり、高温で溶かした固体を使う反応のこと。水溶液でさえ強塩基であるを、純粋な固体で、熱して溶かすという激ヤバ反応です。高校化学では主に、フェノールの製法として登場します。
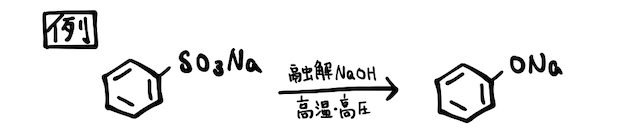
フェノールの製法の他、水に溶けにくい金属酸化物や金属塩を溶かすのに使われることもあります。
詳細
一般に固体を使う反応をアルカリ融解と言いますが、高校化学で頻出の「フェノールの製法」を主に解説します。
フェノールの製法
ベンゼンは置換反応を起こしやすいですが、ベンゼン+で置換反応は起こりません。ベンゼンにはマイナスの電子が密集しており、置換反応を起こすのは陽イオンが攻撃をしたときだったからです。
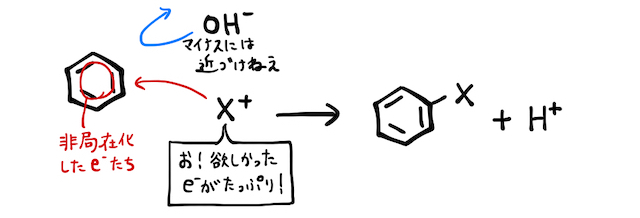
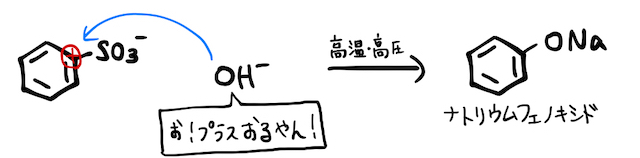
そこで、置換反応で作れるベンゼンスルホン酸を材料に、高温・高圧で固体を加えるという、超過激な方法で無理やりフェノールを作るのがアルカリ融解です。
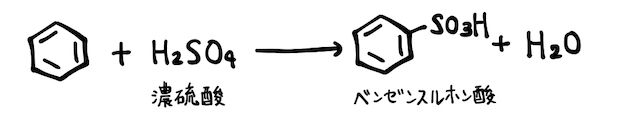
まずベンゼンで勉強した通り、ベンゼン+濃硫酸の置換反応でベンゼンスルホン酸になります。
すると、電子豊富なベンゼン環にスルホ基がくっつきます。実は電気陰性度が大きい元素が集まったスルホ基は、ベンゼン環にくっつくことで少し電子を引き寄せてしまいます。これにより、ベンゼン環に風穴が空くイメージです。
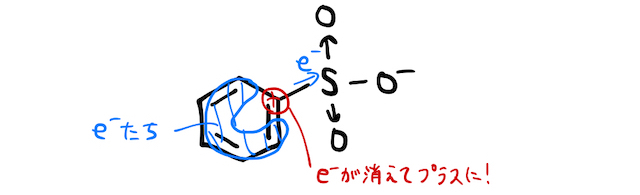
そんなところに、高温・高圧で固体を加え、風穴にをぶち込むことでフェノールが生成されます。ただし正確には、塩基性中なのでナトリウムフェノキシドになります。これを弱酸遊離すればフェノールの完成です。
この方法は、濃・固体のなどいろんな薬品を使ったり、高温高圧にする必要があったり、フェノール以外にゴミができたり、工業的製法としては効率が悪いです。そこで現代では、より効率がいい「クメン法」が使われています。
補足
クロロベンゼンを用いる方法
アルカリ融解に似たフェノールの製法に、クロロベンゼンを用いるものがあります。結論から言えば、この方法は定義上アルカリ融解と呼ばないだけで、反応の仕組みはほぼアルカリ融解です。
まず、クロロベンゼンも置換反応で作れました。クロロ基もスルホ基同様電子を引っ張って、ベンゼンの電子溜まりに風穴が空きます。
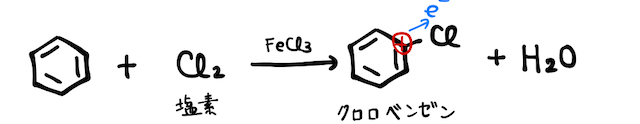
そこに高温・高圧でを反応させます。ただし、クロロベンゼンは沸点が低いため、固体のが液化する条件ではクロロベンゼンが気体になってしまいます。そこで液体同士で反応させられるように条件を整えるため、固体ではなく濃水溶液を用います。とはいえ、反応の仕組みはほぼ同じです。
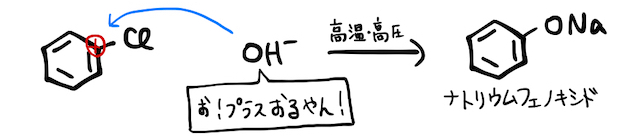
以上、アルカリ融解の定義上、固体を用いていないからアルカリ融解と呼ばれていない、ということでした。













