共有結合
概要
「共有結合」とは、非金属元素同士が電子を共有することでできる結合のこと。複数の原子で電子を共有することで、安定な閉殻構造(オクテット)になっています。
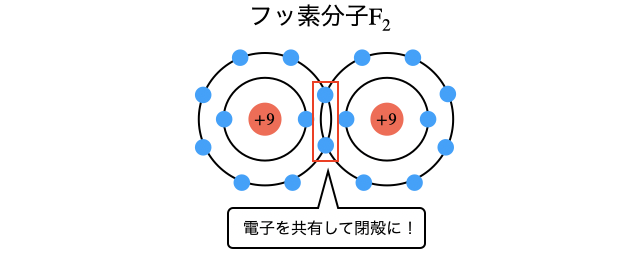
電子大好きな(電気陰性度が大きい)非金属同士なので、電子対をガチガチに引っ張って非常に強い結合を作ります。
詳細
共有結合の仕組み
原子は最外殻に8個の電子を持った閉殻構造で安定化する「オクテット則」というルールがあります。しかし貴ガス以外の元素はこれを満たしません。
そこで原子がお互いの不対電子を持ち合って共有することで閉殻構造を作ろうとします。その結果生じる結合が共有結合です。
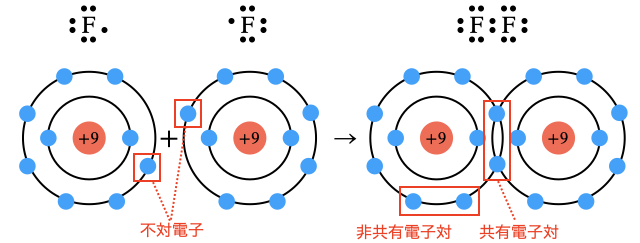
また、共有結合を作るのは非金属元素です。電気陰性度が小さく電子を引っ張る力が弱い金属元素が混ざると「イオン結合」や「金属結合」などの別の結合を作ります。詳しくは各リンク先で!
共有結合の例
共有結合を作る物質の例をいくつか挙げます。ここからは電子式で確認していきます。
(1)水素
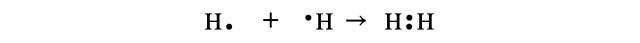
(2)水
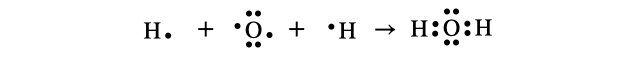
(3)二酸化炭素
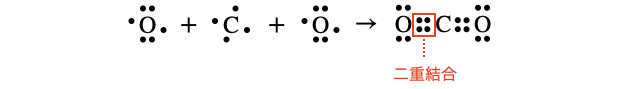
(4)窒素
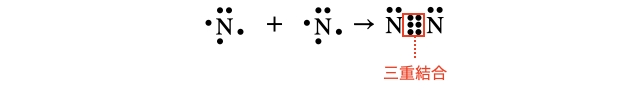
(5)ダイヤモンド
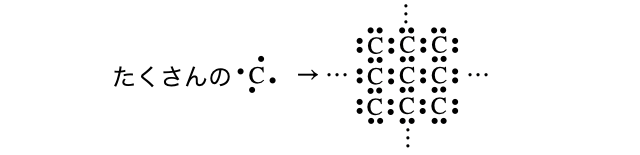
共有結合は分子だけでなく結晶を作ることもあります。受験で知っておきたい共有結合結晶は、ダイヤモンド
共有結合の性質
共有結合を作る物質は、分子か結晶の形をとります。
特に共有結合結晶では、非常に硬く、融点・沸点が非常に高いです。電気陰性度の大きい非金属元素同士が電子対を綱引きのようにガッチリ引っ張るので、全ての結合がガチガチに硬くなるのが理由です。またその結果、結合を作る電子はなかなか動くことができないので電気伝導性も非常に低いです。
補足
- 共有結合は、イオン結合・金属結合と合わせて理解した方がいいです。受験メモ山本の動画・かないTeachannelさんの動画などもチェック!
関連動画








