電子式
概要
「電子式」とは、元素記号の周りに最外殻電子を書き込んだ式のこと。電子式は原子同士がどんな結合を作るかを考えるときに便利です。
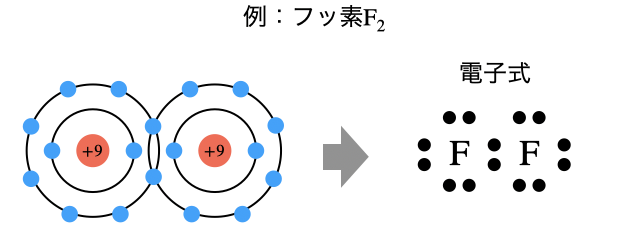
詳細
電子式とは
原則結合に関わる最外殻電子のみに注目した式が電子式です。電子式では中心に元素記号を書き、その周りに最外殻電子を書き込んでいきます。最外殻電子を書き込むときのルールは以下の通り。
- 元素記号の上下左右に最大2個電子を置ける
- まず上下左右の全てに1個入るまでは2個目が入らない
つまりたとえば第2周期の元素を電子式で書くなら以下のようになります。
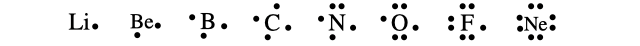
電子式でペアになった電子を電子対、ひとりぼっちの電子を不対電子と言います。
電子式の書き方
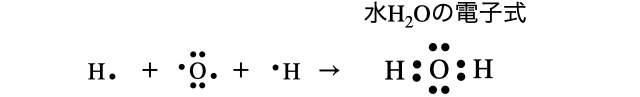
原則原子は、最外殻電子がすべて埋まる閉殻、もしくは8個埋まるオクテットの状態で安定になるので、不対電子を出し合って「共有結合」を作るのでした。これを電子式で表したのが以下です。
また、不対電子を2個ずつ出し合うと二重結合、3個ずつ出し合うと三重結合、片方が電子対を差し出すと配位結合を作ることもあります。
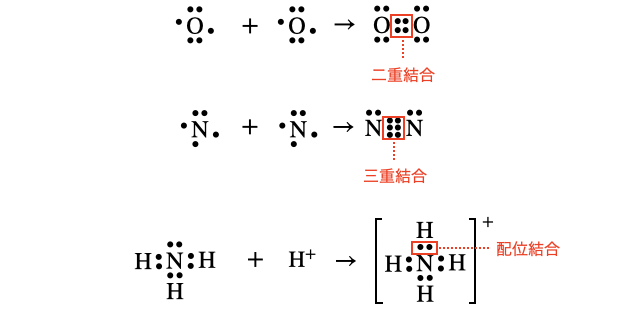
このように、各原子が閉殻になるように最外殻電子を共有させることで電子式が完成します(*注1)。言葉で聞くだけではわからないコツもあるので、問題集で練習をしておきましょう。
例
(1)塩素
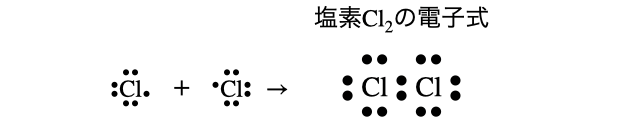
(2)アンモニア
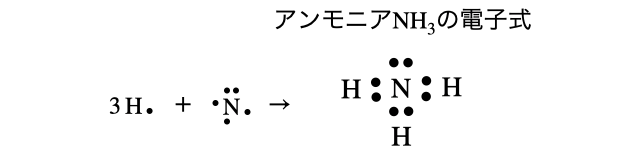
(3)二酸化炭素
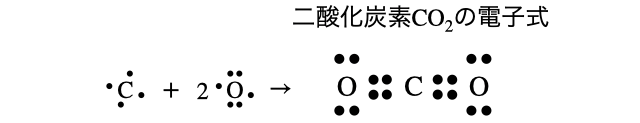
(4)オゾン
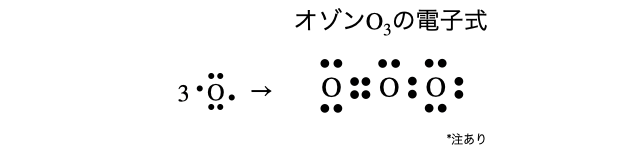
(5)オキソニウムイオン
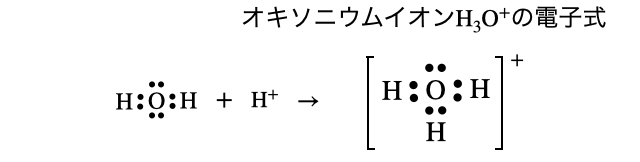
補足
- (*注1)実際にはさまざまな例外があります。ただ例外まで細かく暗記を求められることはないので、とりあえず閉殻を作るパターンを確実に書けるようにしましょう。
- たとえば二酸化窒素は以下のように不対電子を持っています。大学入試でよく出る物質でも、意外とちゃんと考えると難しい物質も多いですね。
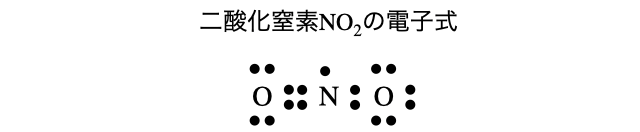
- オゾンは二重結合を持つ酸素分子に対して、酸素原子がもう1つ配位結合した形になっています。電荷の関係も考慮すると正確には以下のように書きます。
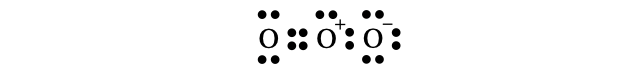
関連動画








