pH
概要
「水素イオン指数pH」とは、溶液の酸性・塩基性の強さを表す値のこと。25℃の水溶液中では、
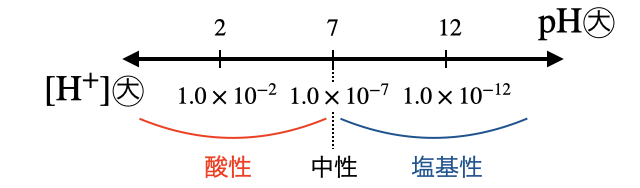
酸性・塩基性は水素イオン濃度
と非常に見づらいです。そこで指数の右肩のみを取り出して、マイナスを外して表示するのが
詳細
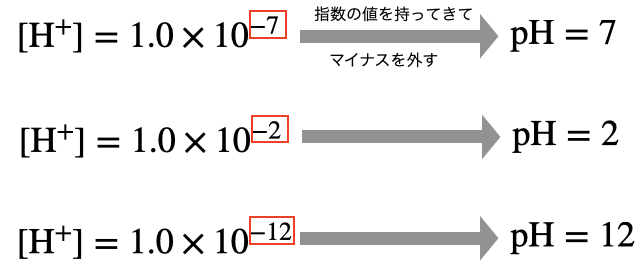
pHの定義
水溶液中の水素イオン濃度
酸のpHの計算方法
水素イオン濃度
【例1】
塩酸は強酸なので100%電離します。よって塩酸の数だけ水素イオンが発生します。
【例2】電離度0.01の
電離度0.01ということは、酢酸のうちの1%が電離して水素イオンを発生すると言うこと。よって、
【例3】
基本は例1と同じ。ただし計算が少し複雑です。
塩基のpHの計算方法
25℃の水溶液中では「水のイオン積」が
つまり塩基性の水溶液では
を求める - 水のイオン積から
を求める - 定義から
を求める
の流れで求めることができます。
【例1】
水酸化ナトリウムは強塩基なので100%電離します。よって水酸化ナトリウムの数だけ水酸化物イオンが発生します。
【例2】電離度0.01の
弱塩基もやることは弱酸と同じ。
酸・塩基の希釈
溶媒を加えて濃度を下げることを希釈と言います。たとえば100mLの溶液に900mLの水を加えて合計1000mLとすることを10倍に希釈すると言います。
結論からいえば、酸を10倍・100倍・1000倍に希釈すると
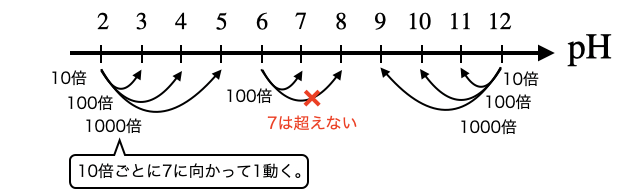
ただし、酸をどんなに希釈しても
【例1】
【例2】
例1では丁寧に計算しましたが「100倍希釈なら
【例3】
公式通り考えれば、
参考:pOH
水素イオン指数
そして水のイオン積の常用対数を考えると
よって
【例】
補足
- 実際はもう少し複雑な計算も登場します。ただよび理系チャンネルさんの動画などもチェック!
- 弱酸・弱塩基の
計算は「電離平衡」を考える必要があります。普通の入試問題では電離度からでなく電離定数からの計算を求められます。詳しくは電離平衡をチェック! - (*注1)薄めすぎると水の電離が無視できなくなります。たとえば
の塩酸を100倍希釈したとき、塩酸から生じる水素イオン濃度は です。仮に純水な(25℃の)水の場合は だから、塩酸が出す より水が電離した の方が多くなるわけです。 - 正確には
なら中性というわけではありません。 中性の正確な定義は です。そしてたとえば25℃の純水の場合は だから、 となって となります。 ただし化学平衡で勉強する通り、平衡定数は温度によって変化します。たとえば の場合は となります。よって の純水では、 となって となります。つまり では が中性ということになります。 以上より、 を中性と考えられるのは25℃のときだけですが、普通入試問題では特別な指示がない限り25℃、 が中性と考えて大丈夫です。
関連動画
関連用語





