フェノール
概要
「フェノール」とは、ベンゼン環の1つの
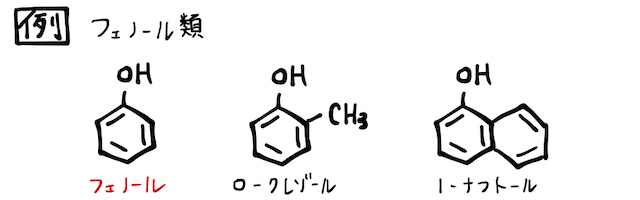
見た目はアルコールっぽいですが、ベンゼン環とのコラボでフェノール類特有の性質も持ちます。

フェノールは、プラスチックのフェノール樹脂の材料で、工業的にはクメン法によって生産されています。
詳細
フェノールとは
フェノールとは、ベンゼン環に
構造はアルコール
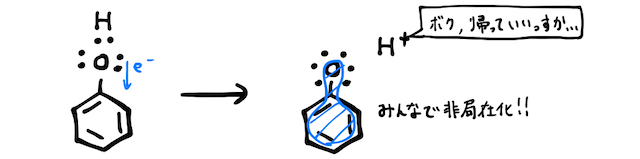
これにより、アルコールよりもヒドロキシ基から
フェノールの反応
(1) 酸としての反応
フェノールは、ベンゼン環とヒドロキシ基の電子が非局在化できることで、
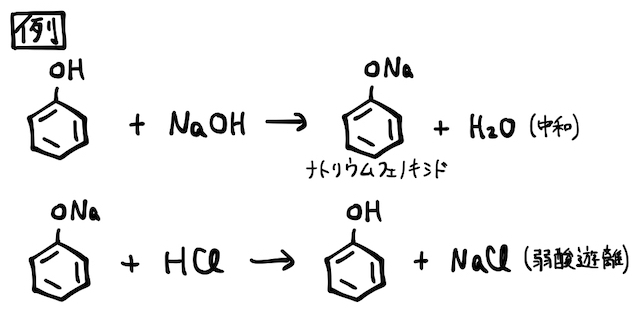
ただし、フェノールは酢酸や炭酸などの弱酸よりもかなり弱いです。そのため、相対的に強い酢酸などにも弱酸遊離を起こすことに注意しましょう。
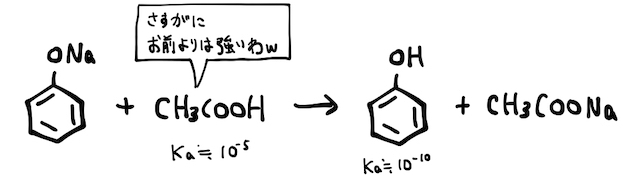
(2) 置換反応
フェノールは、ただのベンゼンよりも置換反応が起こりやすいです。よって、ベンゼンのときよりも緩い条件でも置換反応を起こします。
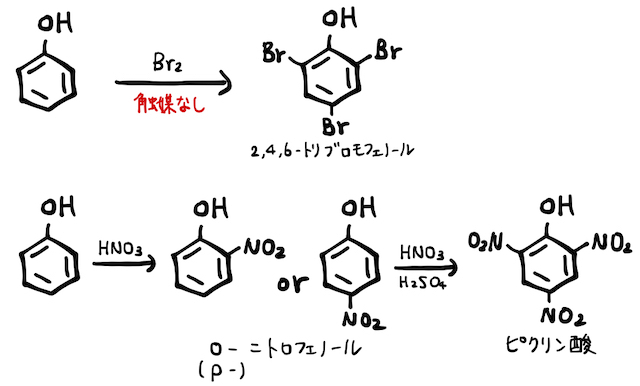
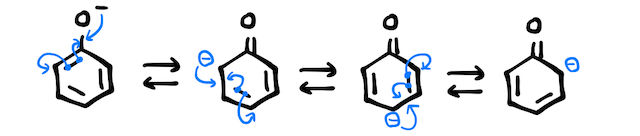
フェノールは、オルト位とパラ位に置換反応が起こりやすい「オルト-パラ配向性」を持ちます。以下のような共鳴構造を考えるとイメージがしやすいです(*補足2)。
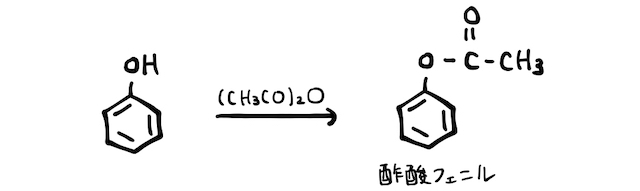
(3) エステル化(アセチル化)
フェノールもエステル化を起こしますが、アルコールよりは反応性が低いです。エステル化は、
よって、より反応性の高い無水酢酸を用いることでエステル化(アセチル化)を起こせます。
(4)
フェノール類に
フェノールの製法
ニトロベンゼンなどは、電子豊富なベンゼンに陽イオンが攻撃する置換反応で作れました。一方で、フェノールを作ろうと
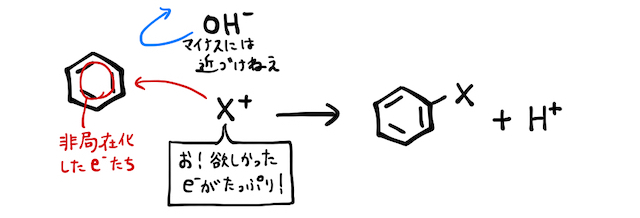
そこでフェノールは、少し遠回りをした複雑な製法で作ります。
(1) アルカリ融解
ベンゼンスルホン酸ナトリウムに、固体の水酸化ナトリウムを高温高圧にして溶かして反応させる方法です。詳しくは「アルカリ融解」の辞書を確認してみましょう。
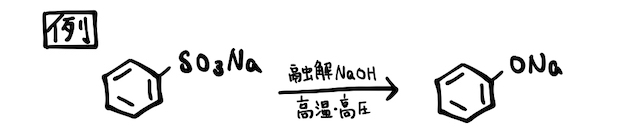
ざっくりだけ説明しておきます。スルホ基は電子吸引性の官能基なので、ベンゼンに非局在化している電子を吸い取ります。これによってスルホ基の根元が微妙にプラスになり、そこ目がけて
(2) クロロベンゼンから作る
(1)とほぼ同じ仕組みの方法です。電子吸引性のクロロ基の根元がプラスになり、
(3) クメン法
現在、主流となっているフェノールの工業的製法が「クメン法」です。(1)(2)は、高温高圧にする必要があったり、不要な副生成物が生じたり、と何かと不便です。しかし、クメン法では比較的簡単にできる上に、副生成物で有用なアセトンが手に入る素晴らしい方法です。
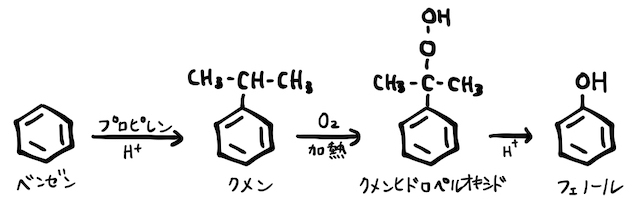
仕組みは複雑なので、原則上の流れを押さえた上で、赤字の物質名を答えられるようにしておけばOKです。もし仕組みに興味があれば、「クメン法」の辞書を確認してみましょう。
補足
- (*補足1)ちなみに当たり前すぎてあげていませんが、もちろん金属ナトリウムとも反応します。イオン化傾向の大きい金属は
と酸化還元反応を起こして溶けますが、水やアルコールは電離度が小さすぎて普通の金属とは反応しません。しかし、金属ナトリウムはあまりにイオン化傾向が大きすぎて、水やアルコールでさえ酸化還元反応を起こします。ということは、それより強いフェノール、炭酸、酢酸、塩酸などは全て金属ナトリウムと反応します。 - (*補足2)細かすぎる話ですが、配向性の話のところで電子の移動を矢印で表していますが、これは大学の有機化学で勉強する「巻き矢印」とは関係ない書き方です。誰も気にしていないと思いますが一応。
関連動画
関連用語





