配向性
概要
「配向性」とは、特定の場所で反応が起こりやすいという性質のこと。電車の席が全部空いてたら一見どこにでも座れるけど100%みんな隅に座る、みたいな感じです。たとえばフェノールへの置換反応では、オルト位・パラ位に優先的に起こり、メタ位には起こりづらいです。
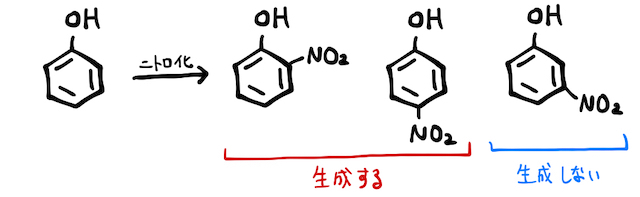
芳香族化合物の配向性は、主にベンゼン環に結合する原子が非共有電子対を持つかどうかで決まります。
詳細
配向性
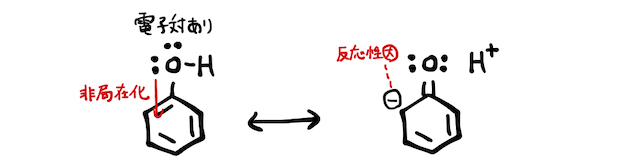
ベンゼン環に官能基がつくと、二重結合の状態が変化します。これは、ベンゼン環が安定に存在できることの説明でも使った、「共鳴」を考えるとわかりやすいです。たとえば、フェノールでは以下のようにたくさんの共鳴構造を取ることができます。
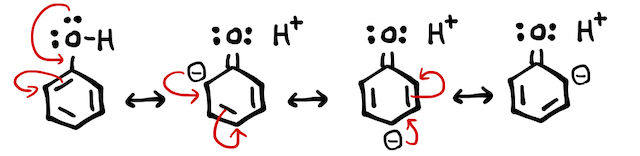
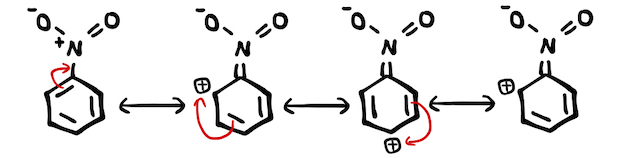
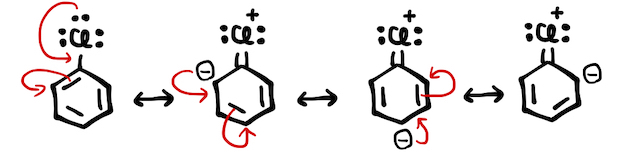
ベンゼンへの置換反応は陽イオンの攻撃から始まるので、共鳴構造を見るとマイナスに帯電したオルト-パラ位に反応が起こりやすそうです(*補足1)。
以上を一般化してまとめます。
以上で挙げた官能基を表にまとめると以下の通り。
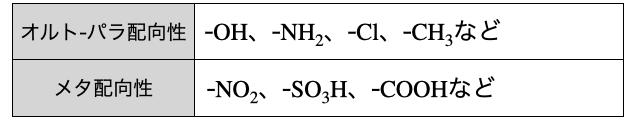
ざっくり、非共有電子対があるならオルト-パラ配向性、ないならメタ配向性、と覚えておきましょう。
より詳細な考察
配向性の詳細は指導要領外なので、以上は大学受験知識の補足程度に説明しましたが、興味がある人向けに一応もう少し詳細にも見ておきます。
実は以上の説明で、配向性を決めるのに2つの要因がありました。つまり、
- 非共有電子対の共有(電子の非局在化)
- 官能基の電気陰性度の影響
です。結論から言えば、配向性や置換反応の反応速度は、この2つの効果によって複合的に決まっていきます。たとえば、ハロゲンである
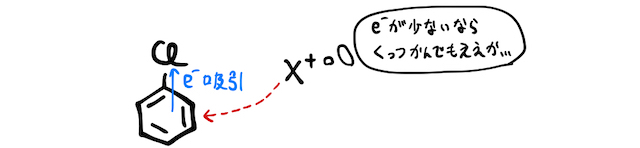
一方で、
この2つの効果の結果、反応速度が遅いオルト-パラ配向性となります。このように、より詳細な反応性を見たい場合は官能基ごとに細かく見ていく必要があります。
補足
- (*補足1)より丁寧には、反応の起こりやすさは反応中間体の安定性で考えます。オルト-パラ位、メタ位に置換する場合の中間体について共鳴構造を考えると、オルト-パラ位がより安定な共鳴構造を持つので反応が起こりやすいです。 ただ受験レベルとしては、そもそも置換反応の結果さえ覚えていればいいので、「マイナスのとこにくっつきやすい」程度に理解しておけばOKです。
- (*補足2)ニトロ基の構造を書くことは少ないですが、実はここでも共鳴(≒非局在化)が起こっています。
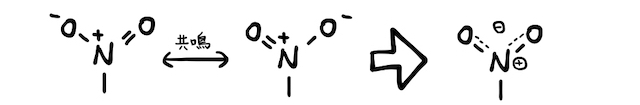
- ちなみに配向性まとめ表に、非共有電子対を持たないメチル基をオルト-パラ配向性を入れました。これは補足2とは逆に、オルト-パラのときの中間体が安定だからです。画像を作る気力がそろそろないので、文章だけの説明ですいません。
- (*補足3)電気陰性度が大きいくせに、共鳴構造の中で
基が電子を渡しているのが矛盾して見えるかもしれません。それだけ非局在化による安定化の効果が大きいということです。つまり、 基的には不満があるかもしれないけど、電子の安定化の度合いが大きく、全体として見ると非局在化をした方が安定化しているというイメージです。
この用語を含むファイル
関連動画
関連用語





