概要
「物質量」とは、ずばり原子の粒々を箱詰めして1箱・2箱...と数えるような数え方。小さすぎる&数が多すぎる原子を1粒ずつ数えるのはひどい拷問なので、約個を1箱分として数えます。このときの「1箱」を「」という単位で呼びます。
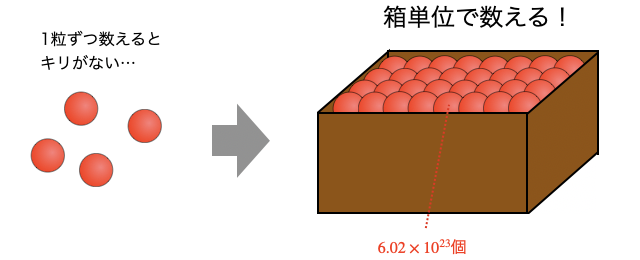
(1箱)に入っている粒の数をアボガドロ定数と言います。この数は、原子を個集めるとちょうど原子量[]になるように決められています。たとえば原子量12の炭素を個(つまり)だけ集めるとになります。
詳細
物質量の(旧)定義
原子は小さすぎ&多すぎるので扱いが面倒です。そのうち小さすぎ問題を解決する方法が「原子量」、多すぎ問題を解決するのが「物質量」です。
たとえば1粒の炭素はですが、毎回こんな数字の計算をするのはたまったもんじゃありません。そこで 「炭素の質量は12」と基準を決めてしまい、相対的に他の原子の質量を決めてしまったのが原子量です。原子量も結構難しいのでわからなければ原子量をチェック!
次に、そんな炭素原子が約個くらい集まって、たとえば鉛筆の芯の黒鉛などができています。これを1粒ずつ数えるのは大変なので、箱詰めしてまとめて数えるのが物質量です。では何粒ずつ箱詰めすると計算がしやすいか、結論から言えば 「1箱分(1mol)の質量が原子量[]になる数」 です。
のをにするためには、以下の計算から約個必要と分かります。
つまり裏を返すと、原子量の炭素は個集めるとちょうどになるということです。

このように個としておくと計算がとても分かりやすくなりますね。よって物質量は 「炭素がちょうどになるような数」 として定義されました。
他の単位との関係
(1)質量
を集めるとになるのでした。そして原子量はを基準に相対的に決められているのだから、どの原子も集めると原子量[]になります。
例1:原子量8のを集めると
例2:分子量18のを集めると
例3:式量56のを集めると
(2)体積
の理想気体は、標準状態(、)でとなります。標準状態であれば多くの気体は理想気体に近似できるので、気体の種類によらず水素も酸素も窒素も集めればです。
補足
- 受験とは関係ありませんが、現在では単に「は個のこと」という新しい定義になっています。歴史的には先ほどの流れがあったけど、今となっては炭素どうこう言うより個数できっぱり定義した方がいい、ということです。まあとはいえ旧定義の流れで理解しておいた方がわかりやすいですし、大学入試では全く問題ありません。






