アルカリ金属
概要
「アルカリ金属」とは、周期表一番左にある第1族元素たち(水素以外)のこと。リチウム
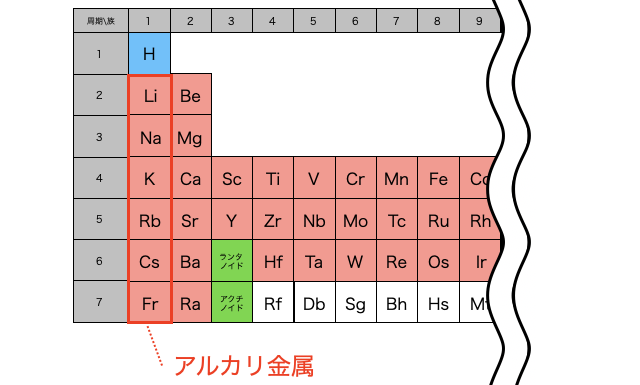
イオン化傾向が大きいため単体はとっても反応性が高く、水に入れると爆発的に反応して水素を出し、空気中に放置すると速攻で酸素に酸化されてしまいます。だから単体の金属を保管したいときには、空気にも水にも触れないように灯油の中に入れておく必要があります。
詳細
ここから先は無機化学を勉強する理系だけが読めばOK。
単体の物理的性質
(1)柔らかい、融点・沸点が低い
単体の金属はどれも柔らかくて融点と沸点が低いです。周期表で下の原子番号が大きいものほど、どんどん柔らかくなります。たとえば、一番硬いリチウム
ざっくり理由も説明しておきましょう。
第1族の元素は価電子を1つしか持たず金属結合に参加できる自由電子も原子1粒につき1粒だけなので、他の金属よりも結合が弱いです。だから固体は柔らかく、温めれば比較的簡単に結合が切れて液体や気体になりやすいです(*)。
(2)密度が小さい
また、アルカリ金属は密度が小さいです。原子量の小さい周期表の上側ほど密度が小さく、特に
(3)炎色反応
アルカリ金属は全て炎色反応を示します(
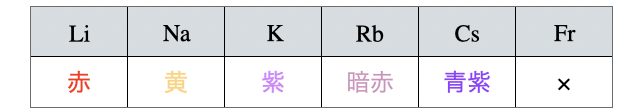
ちなみに味噌汁が吹きこぼれるとガスコンロの火が黄色くなるのは、味噌汁に
単体の化学的性質
反応生の高いアルカリ金属はあらゆる反応を起こしますが、ここでは水と空気との反応だけ紹介しておきます。
(1)水との反応
アルカリ金属は水とたいそう激しく反応します。多くの金属はある程度濃い酸
反応の仕組み自体は、亜鉛が塩酸に溶ける反応などと同じです。
(2)空気(酸素)との反応
アルカリ金属は空気中の酸素と即座に反応します。
表面が酸化されたアルカリ金属をナイフで切ると、断面に金属特有の光沢が見られます。しかしほんの数秒後、空気中の酸素と反応してサビてしまいます。儚いね。
細かすぎる補足
- *価電子が2つあるアルカリ土類金属の方が融点などが高い傾向にあり、結合にd軌道の電子が関わる遷移金属はさらに高いです。d軌道とかイミフって人は無視して。
- 炎色反応で用いるのはアルカリ金属イオンですが、炎色反応の原因物質はアルカリ金属原子と言われています。炎の中でイオンがどこかから電子を受け取りつつ気体化し、加熱により原子内で励起した電子が基底状態に戻るときに発光します。ただし詳しい仕組みは未だにわかっていません。
この用語を含むファイル
関連動画






