モル濃度
概要
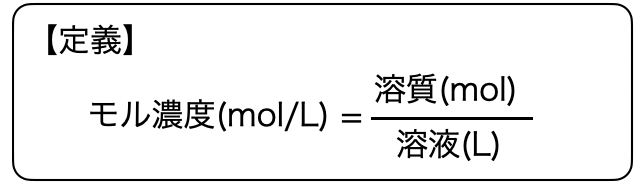
「モル濃度(mol/L)」とは、溶液1L中に溶質の粒々が何molあるかを表したもの。溶液の空間中にどれだけの数の粒子がいるかという"人口密度"的なやつです。
例
(1)0.10molの
(
(2)5.85gの
(
(
詳細
濃度の変換
高校化学で登場する濃度には他に「質量パーセント濃度」「質量モル濃度」があります。これらの濃度をお互いに変換できるようにしておきましょう。

1Lの濃硫酸で考えてみましょう。濃度はコップ1杯でも風呂桶1杯でも同じなので、計算が楽そうな量で考えていいはずです。
密度より1Lの質量は1800gであり、質量パーセント濃度が98%だから、
(溶質[g])
(溶質[mol])
そして溶液はそもそも1Lだったので、
希釈
溶液に対して溶媒のみを加えて、溶液の体積を2倍・3倍・...とすることを「2倍・3倍・...に希釈する」と言います。希釈をすれば溶液中の粒々の数は変わらずに溶液全体の体積だけが2倍・3倍・...と増えるので、モル濃度は1/2倍・1/3倍・...に小さくなります。
たとえば0.20mol/Lの
(
と、2倍希釈すると濃度は1/2倍になります。
補足
- モル濃度は100%理解して計算に使えないといけない概念です。Nagira Academyさん・映像授業TryIt(トライイット)さんなどの動画もチェック!
関連動画







