アルデヒド
概要
「アルデヒド」とは、ホルミル基
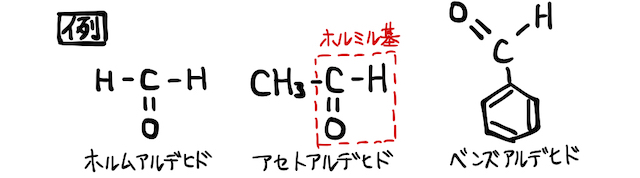
ホルミル基
詳細
アルデヒドとは
アルデヒドは一般に毒性が強い物質で、二日酔いの原因物質のアセトアルデヒド、シックハウス症候群の原因物質のホルムアルデヒドなどがあります。
ホルミル基は極性があるので、低分子量のアルデヒドは水に可溶です。特に、ホルムアルデヒドの約40%水溶液は「ホルマリン」と呼ばれ、生物の標本を作る際の防腐剤などとして使われます。悪そうな科学者の実験室に大抵ある、ヤバそうな液体に臓器とかが入ってるあれです。

アルデヒドの反応
<!--
ホルミル基
(1) 銀鏡反応
アンモニア性硝酸銀水溶液にアルデヒドを加えて加熱すると、試験管の表面に鏡状の銀が張り付く「銀鏡反応」が起こります。
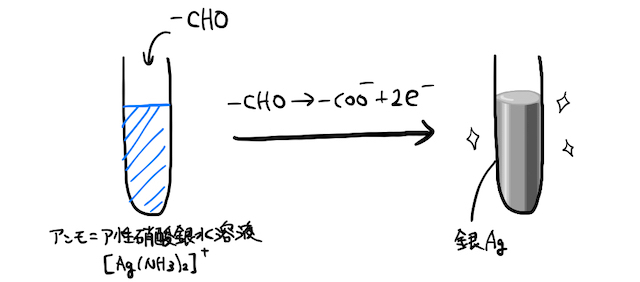
イオン化傾向の小さい銀イオン
ただし、単に塩基性にすると不溶性の塩
(2) フェーリング反応
フェーリング液にアルデヒドを加えて加熱すると、
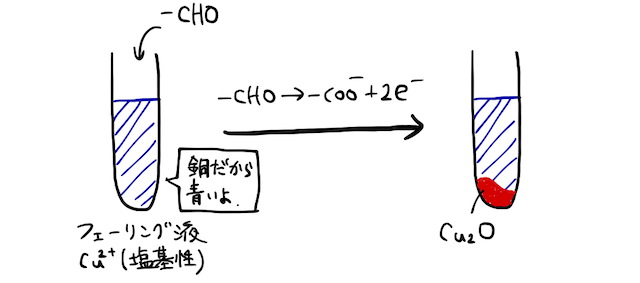
銀鏡反応同様、イオン化傾向の小さい銅イオン
アルデヒドの製法
(1) 第1級アルコールの酸化
アルコールで勉強するように、第1級アルコールを酸化するとアルデヒドを経てカルボン酸になります。
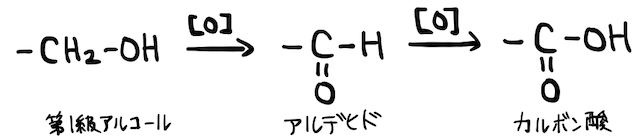
特定の酸化剤を使うと、以上の反応をアルデヒドまでで止めることができます(*補足1)。
(2) アセチレンへの水の付加
アルキンで勉強するように、アセチレンに触媒下で水を付加すると、不安定なビニルアルコールを経てアセトアルデヒド
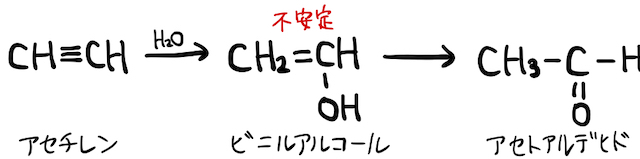
ちなみにこの方法は、以前はアセトアルデヒドの工業的製法として用いられていましたが、触媒に含まれる水銀が有機物と反応して流出し、水俣病という公害の原因となりました。よって現在では(3)の方法が主流です。
(3) ヘキスト・ワッカー法(応用)
触媒として塩化パラジウム

アセトアルデヒドの現在の工業的製法なので、余裕がある人は頭の片隅に入れておきましょう。
補足
- (*補足1)構造決定の問題では、第1級アルコールを酸化したというだけではアルデヒドかカルボン酸かわかりませんが、生成物の性質を見てどちらか判断します。
関連動画







