ラジカル
概要
「ラジカル」とは、不対電子を持つ原子や分子、イオンなどのこと。ラジカルはオクテット則を満たしていないので、反応性が非常に高くさまざまな反応のきっかけとなります。
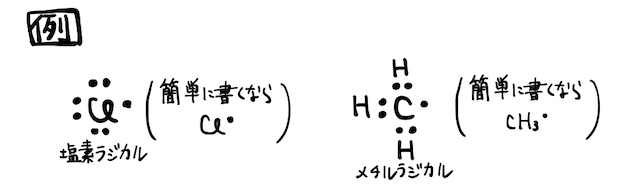
ラジカルは高校化学範囲外の知識ですが、特に有機化学の反応を理解するのに役立つので、余裕がある人は確認しておきましょう。
詳細
ラジカルとは
ラジカルとは、不対電子を持つ粒子のことです。オクテット則を満たさないため非常に不安定ですが、光・熱などのエネルギーで共有結合が切れるなどして発生することが多いです。
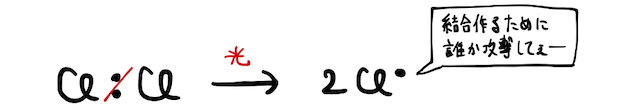
たとえば上図の例で言えば、塩素分子
ラジカルが関わる反応
ラジカルが関わる反応は熱や光などによって開始し、連鎖的に反応が進行します。不対電子を持つラジカルが分子にぶつかって結合を作ると、代わりに他の誰かがラジカルになってしまいます。そのラジカルがまた反応を起こして、...、とはちゃめちゃになるわけです。
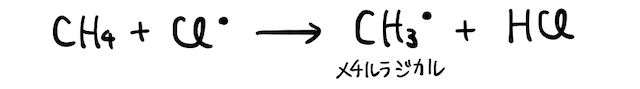
以下では具体的なラジカル反応の例を見ていきます。
(1) 燃焼反応
燃焼反応は、熱によって生じるラジカルが関わる反応です。反応の仕組みは超複雑ですが、水素の燃焼を例にいくつか取り上げてみるなら以下の通り。
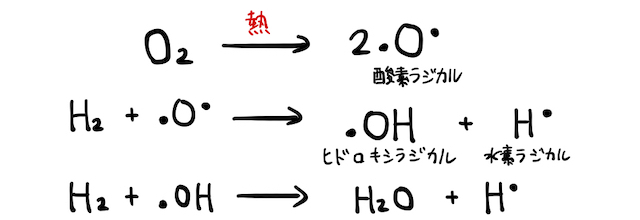
その他、100種類近い反応が連鎖的に起こって、ラジカルによる酸化還元反応が起こっています。
(2) アルカンへの置換反応
たとえば、アルカンへの塩素
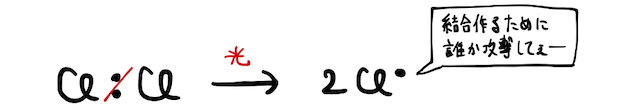
これによって生じた塩素ラジカルがアルカンを攻撃し、塩化水素
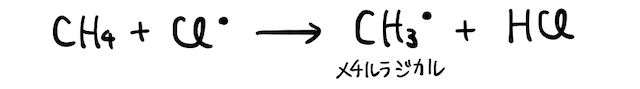
そしてそいつがさらに塩素
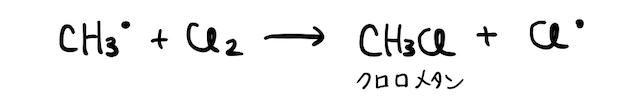
以上をまとめると、
という反応が起こりました。ただし実際には、以上の反応後もラジカルが残っているので、連鎖的に反応が起こり続けます。クロロメタンにさらに塩素が置換したり、ラジカル同士がぶつかって結合したり、カオスな状態になるわけですね。
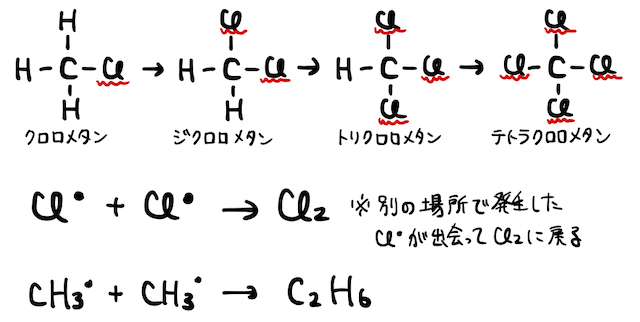
(3) 付加重合
合成高分子化合物を作る付加重合でもラジカルが利用されています。たとえば、ビニール袋の材料であるポリエチレン(*補足1)は、単量体であるエチレンを用意するだけでは反応が開始しません。反応開始材として、加熱によってラジカルとなる過酸化ベンゾイルを加えます。
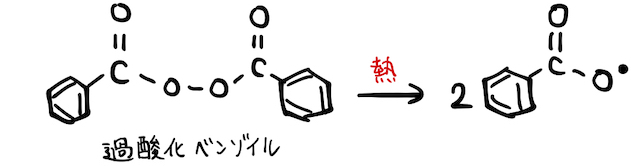
すると、二重結合にラジカルが攻撃を仕掛けることで、π結合の電子対の片方が結合に使われ、もう片方が不対電子として残ることでエチレンがラジカルとなります。
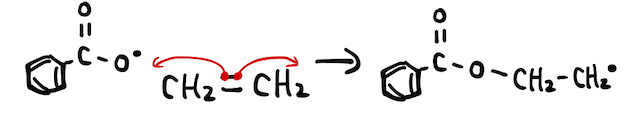
あとはこいつが隣のエチレンにぶつかり、さらに隣のエチレンにぶつかり、...、によって付加重合が起こるわけです。玉突き事故的なノリです。
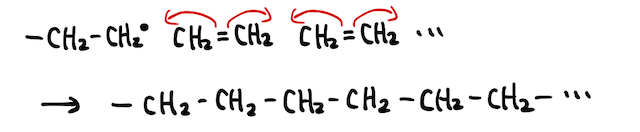
補足
- (*補足1)元々は、ポリ塩化ビニルからできる袋だからビーニル袋と呼ばれていました。しかし、ポリ塩化ビニルには環境に悪い塩素が含まれることから、現在はポリエチレン製のポリ袋が主流です。それでも材料に関係なく、習慣的にビニール袋と呼ばれがちです。
関連動画







