蒸気圧降下
概要
「蒸気圧降下」とは、ざっくり言えば溶液では蒸気圧が下がるという現象のこと。正確には、「不揮発性の溶質」を溶かした溶液で蒸気圧が下がる現象です。
蒸気圧が下がると下図のように蒸気圧曲線が下がり、それによって「沸点上昇」が起こります。
詳細
蒸気圧が下がる仕組み
いきなりざっくり言えば、溶媒の蒸発を溶質がブロックすることで蒸発が抑えられ蒸気圧が下がる、というのが蒸気圧降下の仕組みです。
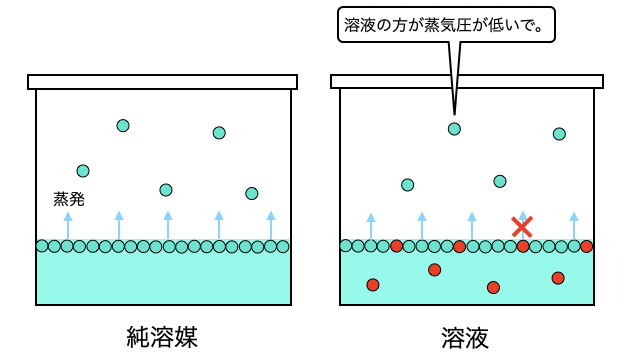
もう少し丁寧に見ていきましょう。そもそも「蒸気圧」とは蒸発スピードと凝縮スピードがつりあう気液平衡状態の圧力のことです。しかし溶媒に対して不揮発性の溶質が溶けると、溶液の表面に一定確率で溶質がやってきて、蒸発スピードが下がってしまいます。
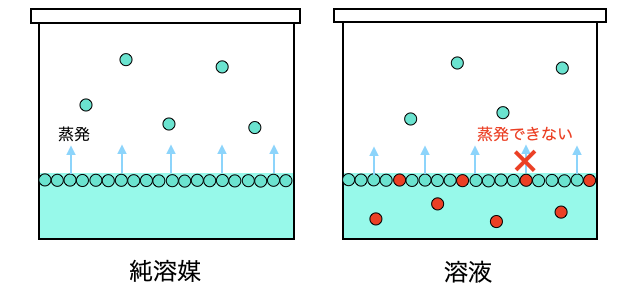
蒸発スピードが下がった結果、圧力が下がった状態で気液平衡に達するため蒸気圧が下がるということになります。
ラウールの法則
基本的には「溶液では蒸気圧が下がる」だけ知っておけば十分ですが、ごく稀に「どのくらい蒸気圧が下がるのか」を計算する問題が出題される場合があります(*注1)。そこで、蒸気圧の下がり具合に関する法則であるラウールの法則を紹介しておきます。

希薄溶液の蒸気圧は、純溶媒の蒸気圧を溶液全体に対する溶媒分子のモル分率倍した値になる、というのがラウールの法則です(*注2)。言葉で聞くと難しそうですが実は図で考えれば簡単です。
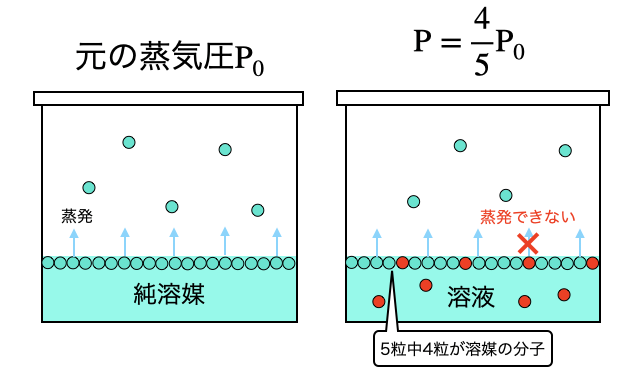
たとえば5粒中1粒が溶質であれば、蒸発しようとしても1/5の確率で溶媒表面の溶質に邪魔されます。その結果、蒸気圧は4/5倍になってしまいます。これがラウールの法則です。
補足
- (*注1)その場合は問題文でラウールの法則が紹介され、それを読めば解ける問題にはなっているはずですが。
- (*注2)実際は溶媒と溶質の分子間力の違いなどにより、ラウールの法則は成り立たなくなりますが、希薄溶液や構造の似た物質(ベンゼン+トルエンなど)の混合溶液では近い値になります。
関連動画






