凝固点降下
概要
「凝固点降下」とは、不揮発性の溶質が溶けた溶液では純溶媒よりも凝固点が下がる現象のこと。ただの水よりも塩や砂糖が混ざった溶液の方が凝固点が低くなるということです。これによって例えば氷水に塩を入れると0℃より低くなります。
希薄溶液において凝固点が下がる度合いは「質量モル濃度」に比例し、定数

詳細
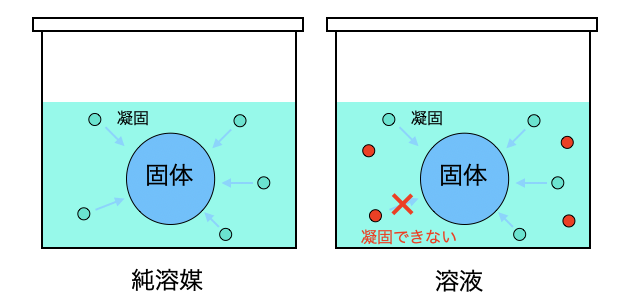
凝固点降下の仕組み
凝固点降下は「蒸気圧降下・沸点上昇」と同じく、固体の表面に溶質があると一定確率で溶媒が凝固するのを邪魔するようなイメージです。
凝固点降下度の求め方
凝固点の下がり具合を「凝固点降下度」といい、希薄溶液では溶液の質量モル濃度に比例します(*注1)。この結果だけを覚えて使えるようにしましょう。

なぜ質量モル濃度に比例するかは、大学の物理学の知識がないとわかりません。ただ物理選択の人は真面目に大学で真面目に熱力学を勉強していくと「お前は、大学受験のときの勉強した凝固点降下...!また出会ったな。」と戦友と出会った気持ちになれるので、ここでは公式を覚えておいて大学での再会を楽しみにしておきましょう。
補足
- (*注1)希薄溶液の性質では、「粒の数の濃度」で考える必要がありましたね。だから例えば
の 水溶液では、 が完全に電離するため粒の濃度 として考える必要があります。
関連動画
関連用語





