状態図
概要
「状態図」とは、ある温度・圧力で平衡状態になったときに気・液・固のどの状態になるかを表した図のこと。それぞれの状態の境目を線で区切り、温度や圧力を変化させて線を跨ぐときに状態変化が起こります。
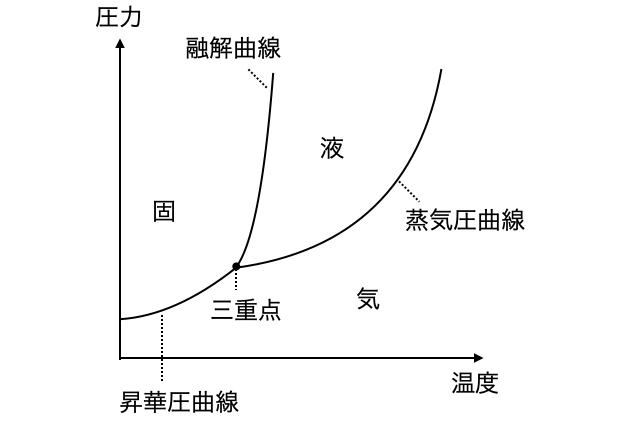
気・液の境目を蒸気圧曲線、液・固の境目を融解曲線、固・気の境目を昇華圧曲線と言い、2つの状態が平衡状態で共存しています。また3状態が重なる点を三重点と言い、3つの状態が共存します。
詳細
状態図
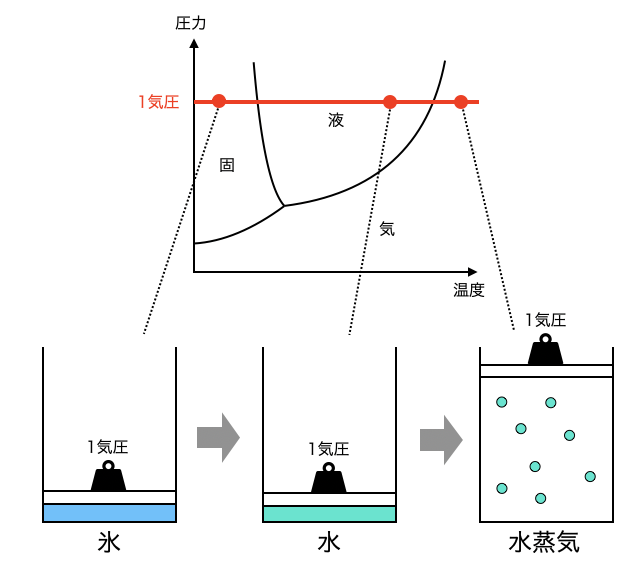
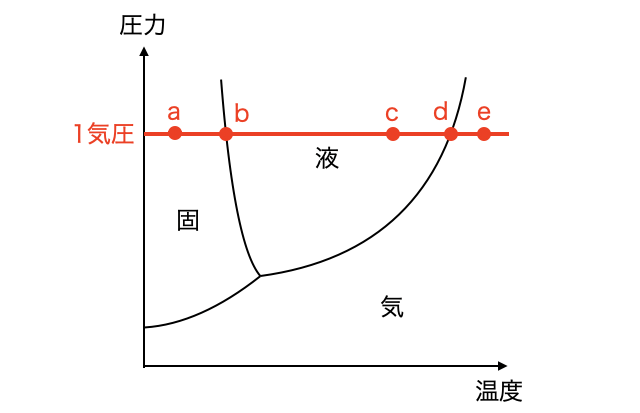
状態図は、ある温度・圧力で平衡状態になったときに気・液・固のどの状態になるかを表します。たとえば、水の状態図で1気圧の場合だけを考えると、温度によって以下のように状態が変化します。
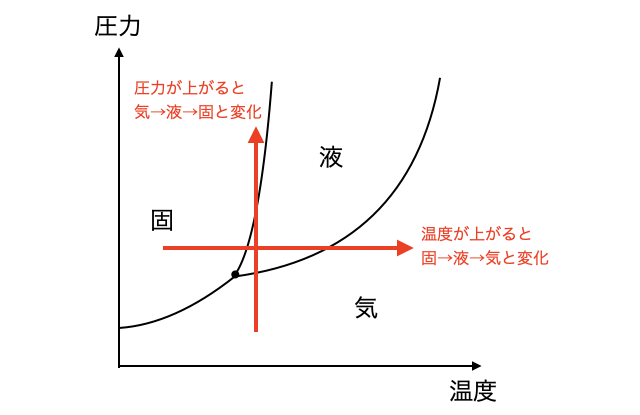
「状態変化」で勉強した通り、一般には温度が高いほどバラバラになりたがり固→液→気と変化し、圧力が高いほど密度が高い気→液→固へと変化します。その結果、境目の線は右上がりになります。
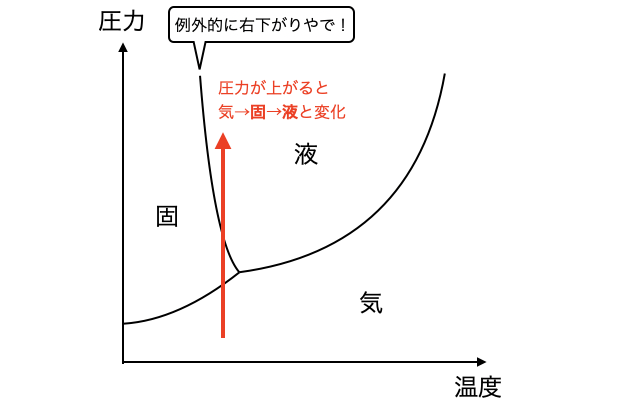
ただし、水
状態の境目
それぞれの状態の境目で、
- 蒸気圧曲線では、気・液が気液平衡の状態で共存
- 融解曲線では、液・固が固液平衡の状態で共存
- 昇華圧曲線では、固・気が共存(*注1)
して存在しています。状態図では、それぞれの曲線上の点は1点ですが、気体ばかりの気液平衡や液体ばかりの気液平衡など、割合はいろいろと変わることに注意しましょう。
たとえば水を1気圧で温度を変化させたとき、下図の赤いライン上を状態が変化していきます。
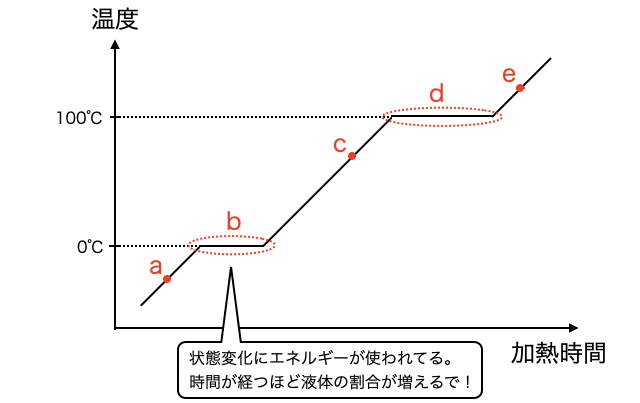
氷の状態から一定の勢いで温めたとき、時間に対して温度の上がり方を示した図が以下です。状態変化自体にエネルギーが必要なため、状態変化中は温度が一定のまましばらく加熱が必要です。
参考:超臨界流体
大学入試ではほぼ問われないので省きましたが、超高温・高圧では気体と液体の区別がつかない「超臨界流体」と言う状態になります。また、状態図上で超臨界流体となる点を「臨界点」と言います。
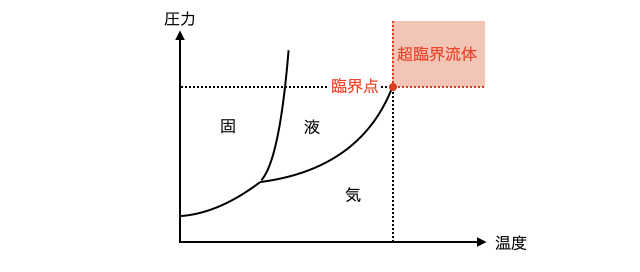
受験知識的には「超臨界流体、臨界点」の名前さえ覚えていればOK。ただ、もし細かいことが気になる人は「超臨界流体」の辞書をチェック!
補足
- (*注1)「固気平衡」と呼ぶこともありますが、入試レベルで登場することはありません。
- 1気圧でも0℃以下の温度になる「過冷却」は凝固がスタートする前の非平衡状態(準安定状態)です。時間が経って平衡状態になれば0℃に戻ります。
この用語を含むファイル
関連動画







