気液平衡
概要
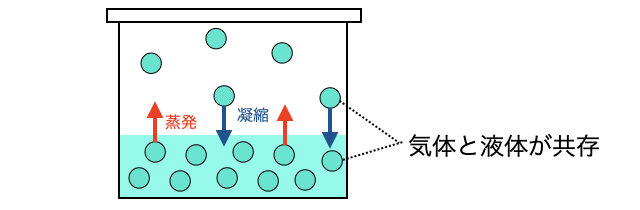
「気液平衡」とは、蒸発と凝縮のスピードがつり合って気体と液体が共存する状態のこと。
ダイエットで必死に走ってカロリーを消費しても、その分たくさん食べたら体重はプラマイゼロになるのと同じです。例えがわかりにくいですね。
詳細
状態変化の基礎
分子は、
- 運動エネルギーによってバラバラになる
- 分子間力によってくっつく
という逆向きの勢いがあります。特に気体分子の運動エネルギーは温度に比例するので、温度が高いほどバラバラになりたがり、温度が低いほどくっつきたがります。温度を上げると水が沸騰したりすることからもイメージが湧きますね。
気液平衡
気体分子の中でも、運動エネルギーが小さくなったやつは分子間力に引っ張られて液体に凝縮してしまいます。逆に、液体の中でも運動エネルギーが大きくなったやつは分子間力を振り切って気体に蒸発します。この勢いがつり合った結果、見かけ上液体と気体の量に変化がないように見えるのが気液平衡です。
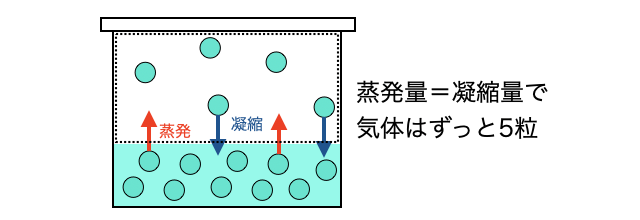
同じ温度であれば、分子たちの運動エネルギーの平均値が同じなので、いつも同じ気液平衡状態に落ち着きます。上の図で言えば、わざと気体分子を消したり増やしたりしても、温度が一定なら必ず気体が5粒の状態に向かうわけです(*注1)。
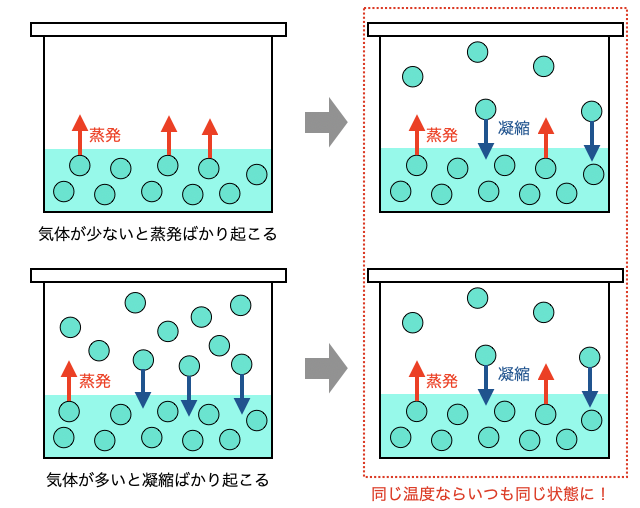
また、蒸発と凝縮のスピードは温度によって変わり、温度が高いほど気体分子の数が多い気液平衡状態になります。
蒸気圧
先ほど、気液平衡状態では同じ温度なら気体の「粒の数」が一定となると言いましたが、気体の量は正確には「蒸気圧」という圧力で数えます。詳しくは蒸気圧のページで!
補足
- (*注1)正確には粒の数ではなく圧力が一定になります。だから温度一定でも体積が2倍になれば10粒になります。詳しくは「蒸気圧」で。
この用語を含むファイル
関連動画






