概要
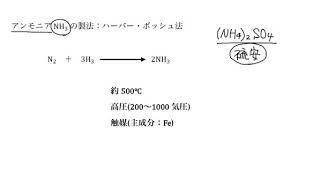
アンモニア()は、四酸化三鉄()を主成分とする触媒の下、窒素と水素を高圧で合成することで工業的に製造される。
この製法はハーバー・ボッシュ法と呼ばれる。
これにより、空気中に安定的に存在する窒素を、科学的に利用可能なアンモニアへと変換することができる。
詳細
この反応は可逆反応であり、アンモニアを多く作りたければ、高圧にすれば良い。(圧力を高くすると、ルシャトリエの原理 より、物質量を減らして圧力を減らす方向に平衡が動くので、正反応がどんどん進むことになる!)
一方で、この正反応()は発熱反応であり、ルシャトリエの原理を考えると、低温で反応させた方が良さそうだが、低温にすると分子の熱運動も穏やかになり反応速度が落ちてしまうため、一長一短である。そこで、バランスをとって中程度の温度() で設定し、触媒を用いることで反応を促進している。
補足
ややこしいので、他の工業的製法の名称もまとめて押さえておこう。
- ハーバー・ボッシュ法:アンモニアの工業的製法
- オストワルト法:硝酸の工業的製法
- 接触法:硫酸の工業的製法
- ソルベー法(アンモニアソーダ法):炭酸ナトリウムの工業的製法
また、触媒についてもおまけでまとめておく。代表的な触媒は覚えておくしかない。
- 白金():オストワルト法での、アンモニア()→ 一酸化窒素()の反応の触媒
- 四酸化三鉄():今回のハーバー・ボッシュ法での、窒素と水素 → アンモニア()の反応の触媒
- 酸化バナジウム()():接触法での、二酸化硫黄()→ 三酸化硫黄()の反応の触媒
- 酸化マンガン()():酸素の製法での、過酸化水素()→ 酸素()の反応の触媒