ソルベー法
概要
炭酸ナトリウム(
全体をまとめた反応式は以下の通り。
途中で出てきた二酸化炭素(
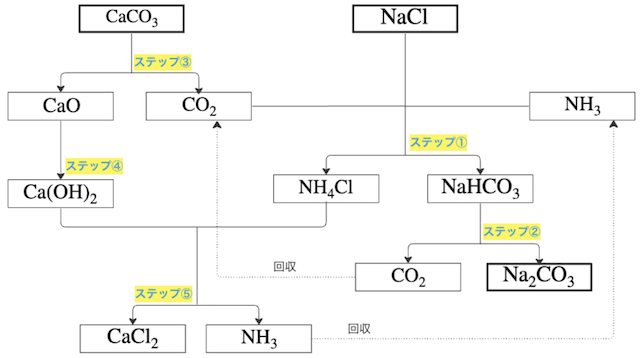
詳細
では、上のステップ①〜⑤のそれぞれの反応を詳しく見てみよう!
ステップ①
塩化ナトリウムの飽和水溶液に、アンモニアを吸収させて、二酸化炭素を吹き込むと、以下の反応で炭酸水素ナトリウム(
※ ちなみにアンモニアを加える理由は、水溶液を塩基性にして炭酸(二酸化炭素+水)との中和反応が起こるようにすることで、二酸化炭素の溶解量を大きくして、溶液中の
ステップ②
ステップ①で沈殿した炭酸水素ナトリウムを加熱して分解することで、炭酸カルシウム(
※ ここで一緒に生じた二酸化炭素(
ステップ③
炭酸カルシウム(
※ ここで一緒に生じた二酸化炭素(
ステップ④
ステップ③で生じた酸化カルシウム(
ステップ⑤
ステップ④で生じた水酸化カルシウム(
※ これは弱塩基の遊離反応である点に着目。つまり、アンモニア(
※ ここで一緒に生じたアンモニア(
まとめ
以上、ステップ①〜⑤の反応をまとめると、ソルベー法の工程をまとめた全体の反応は以下の通り。
※ ステップ①の式を
最後に全体のイメージ図をもう一度貼っておく。

補足
ベルギーの工業家のソルベーさんが実際に反応塔を作り、この工業化に成功したことから、「ソルベー法」と呼ばれる。
また、ステップ①で見た通り、「アンモニア」をうまく活用して反応を進めていることと、作っている炭酸ナトリウム(
また、ややこしいので、他の工業的製法の名称もまとめて押さえておこう。
- ハーバー・ボッシュ法:アンモニアの工業的製法
- オストワルト法:硝酸の工業的製法
- 接触法:硫酸の工業的製法
- ソルベー法(アンモニアソーダ法):炭酸ナトリウムの工業的製法
関連動画
関連用語




