接触法
概要
硫酸(
① 硫黄を燃焼させて、二酸化硫黄を作る。
※ 黄鉄鉱(
② 作った二酸化硫黄を、酸化バナジウム(
③ 三酸化硫黄を濃硫酸に吸収させて発煙硫酸とし、希硫酸で薄めて濃硫酸を作る。
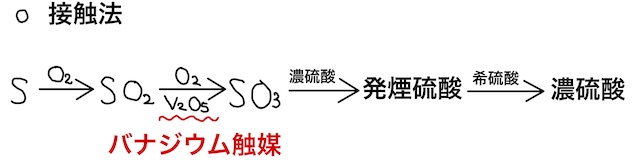
詳細
ステップ③で、なぜ単に三酸化硫黄を水に溶かすのではダメなのかを考えてみよう。
実は、単に三酸化硫黄を水に溶かそうとすると、発熱量が大きく、水が沸騰し、発生した水蒸気に三酸化硫黄が溶けて、空気中に硫酸が発煙してしまう。そのため、水にはほとんど吸収されないことになる。
そのため、ここのステップでは、発熱をなるべく抑えるために、濃硫酸に含まれる水にゆっくりと吸収させている。(過剰に吸収させると、三酸化硫黄の蒸気が生じてくるため、「発煙硫酸」という名前がついている)
例題
【問】硫黄
【答】上の反応の流れからわかるように、硫黄
よって、
が成り立つ。(用いた硫黄
これを解いて、
と求められる。
補足
ややこしいので、他の工業的製法の名称もまとめて押さえておこう。
- ハーバー・ボッシュ法:アンモニアの工業的製法
- オストワルト法:硝酸の工業的製法
- 接触法:硫酸の工業的製法
- ソルベー法(アンモニアソーダ法):炭酸ナトリウムの工業的製法
また、触媒についてもおまけでまとめておく。代表的な触媒は覚えておくしかない。
- 白金(
):オストワルト法での、アンモニア( )→ 一酸化窒素( )の反応の触媒 - 四酸化三鉄(
):ハーバー・ボッシュ法での、窒素と水素 → アンモニア( )の反応の触媒 - 酸化バナジウム(
)( ):今回の接触法での、二酸化硫黄( )→ 三酸化硫黄( )の反応の触媒 - 酸化マンガン(
)( ):酸素の製法での、過酸化水素( )→ 酸素( )の反応の触媒
関連動画
関連用語




