単体
概要
「単体」とは、1種類の元素からできる純物質のこと。水素
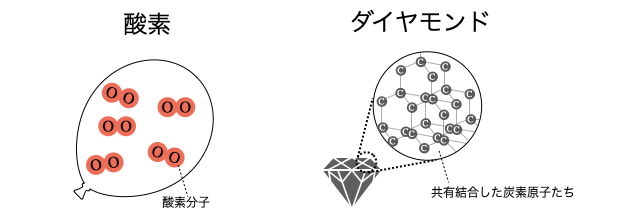
また単体とは逆に、水
酸素
詳細
化学で一番最初あたりに習う単体ですが、いろんな言葉とごちゃごちゃになりやすいです。わかってしまえば簡単だから不安な人はちゃんと確認しとこう!
単体と純物質の違い
単体であろうが化合物であろうが、1種類の物質を集めたのが純物質です。たとえば
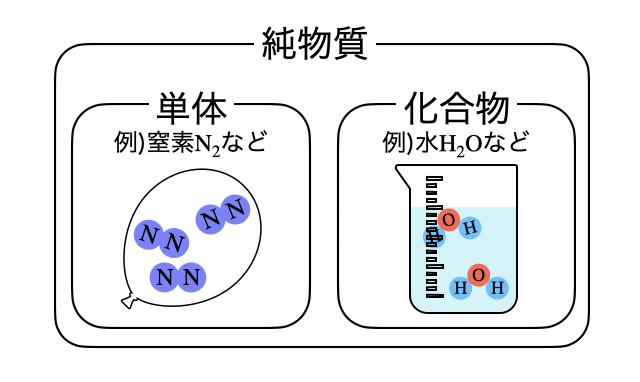
なんとなく定義が似ている単体と純物質ですが、具体例と一緒に覚えれば簡単ですね。
単体と元素の違い
まずざっくりイメージを言うなら、
- 気体・液体・固体などのリアルな物質を指しているのが単体
- 物質の成分である原子レベルで指しているのが元素
です。
たとえば「水を電気分解すると【酸素】と水素が生じる」という文章では、実際に発生する気体の酸素を指しているので、括弧の酸素は単体です。
一方、「地殻全体の質量の約半分は【酸素】である」という文章では、砂に含まれる二酸化ケイ素
また「お味噌汁の中には【ナトリウム】が含まれる」も、塩化ナトリウム
実際に物質をイメージすると判別がしやすいですね。
補足
- 「じゃあ元素と原子の違いはなんなんですか!!!!」と思っているあなたは元素の説明を確認しましょう。
関連動画







