酸化剤
概要
「酸化剤」とは、酸化還元反応で電子を奪うやつのこと。電子を奪うことで相手を酸化し、自分は電子を受け取ることで還元されます。
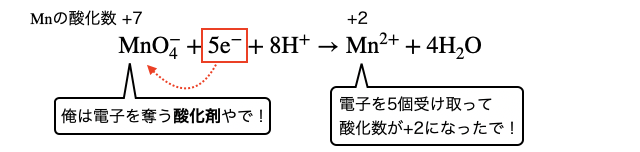
電子を求めている物質ほど酸化剤になりやすいです。 単体であれば例えば電気陰性度の大きい元素からなるハロゲン、化合物であれば酸化数(=電子の過不足具合)が大きい原子を持つ物質などです。
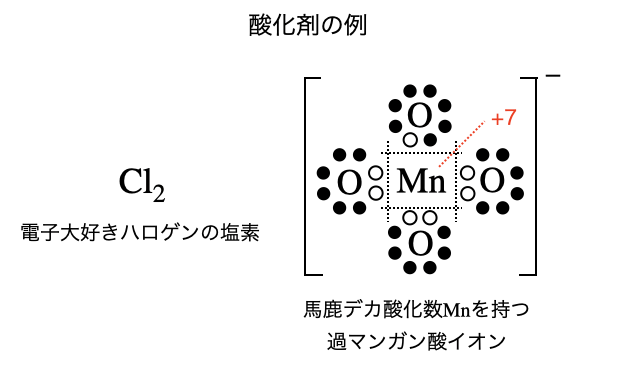
ただし酸化還元反応で実際に酸化剤や還元剤になるかどうかは相手の物質にもよります。たとえば、過酸化水素
詳細
酸化剤
「酸化数」とはそもそも奪った/奪われた電荷の大きさのことでした。つまり電子を奪われて酸化数が大きい原子を持つ物質は酸化剤として働きやすい傾向にあります。特に、電子大好きな酸素
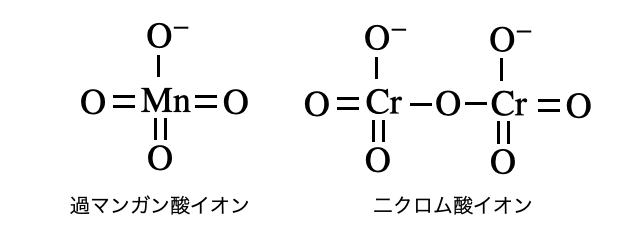
覚えたい酸化剤
大学入試においては、基本的な酸化剤が酸化還元反応を起こした後の生成物を覚えておく必要があります。反応物と生成物のペアを覚えておけば半反応式は自分で作ることができます。
(酸性) (中性・塩基性) - 濃
- 希
- 熱濃
- ハロゲン
絶望的な量、酸化剤を嫌いになっても化学は嫌いにならないでください。とはいえ 「半反応式の作り方」を勉強している間に以外と自然に覚えられるので、必死に書き取りするとかはしなくて大丈夫です。
補足
- 酸化数以外にも物質の安定や反応相手などが総合的に影響して酸化剤・還元剤として働くかが決まります。たとえば同じ元素・同じ酸化数である
と では、 は強い酸化剤ですが は加熱しないと酸化剤として働きません。その理由の1つに、 は分子同士で大量に水素結合を作って安定化しているから反応によって変化しづらいことが挙げられます。
関連動画








