半反応式
概要
「半反応式」とは、酸化還元反応で電子の動きに注目した式のこと。酸化剤が奪う電子or還元剤が与える電子のどちらかだけに注目した"半分の反応式"です。
反応物と生成物の組を知っていれば、半反応式は自分で作ることができます。具体的には、
- 反応物と生成物を書く
- 酸化数変化から奪う/奪われる電子を書く
か で両辺の電荷を一致させる - 水
で両辺の原子数を一致させる
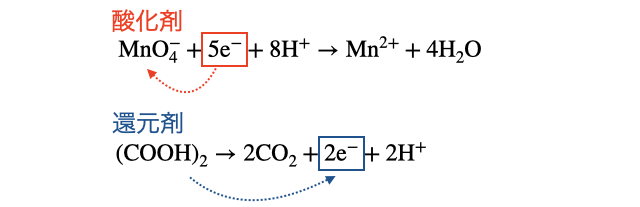
の4段階で半反応式が作れます。たとえば硫酸酸性の過マンガン酸イオン
(マンガンの酸化数が+7→+2) (硫酸酸性なので水溶液中に多い で調整)
と半反応式を作ることができます。
詳細
教科書には大量の半反応式が書かれていて「これを覚えるの〜...」って思いがちですが、実は以下の手順で自分で作ることができます。
- 反応物と生成物を書く
- 酸化数変化から奪う/奪われる電子を書く
か で両辺の電荷を一致させる - 水
で両辺の原子数を一致させる
ここでは硫酸酸性の過マンガン酸カリウム
1. 反応物と生成物を書く
反応物と生成物のペアは覚えるしかありません。「酸化剤」と「還元剤」でそれぞれまとめておいたので目を通しておきましょう。
過マンガン酸カリウムの場合は以下の通り。
ちなみに、カリウムイオン
と両辺で被ってしまうため、反応の前後で変化しない
2. 酸化数変化から電子を調整
酸化数は電子の過不足具合いのことでした。たとえば
このようにして電子を書き込みます。ちなみに還元剤であれば余った電子を放出するので、右辺に書き込むことになります。
3.
反応の前後で電荷が変化するのはおかしいので、
ちなみに、
と書いてもいいですが、
4. 水
最後に水で原子数を調整します。
これで半反応式の完成です!以上の流れを、「酸化剤」「還元剤」で紹介した物質の全てで試すともう酸化還元反応は得意になりますよ!
半反応式から酸化還元反応へ
酸化剤と還元剤の半反応式が作れれば、酸化還元反応式を作ることができます。詳しくは「酸化還元反応」をチェック!
補足
- 酸化還元反応はかなり複雑なので、受験メモ山本の動画、化学好きな東工大生・かずきさんの動画、かないTeachannelさんの動画などもチェック!
- 先生によって、半反応式を作る順番が違ったりします(2で水を足したり)。ただどの手順でも機械的に作れるようになっているので安心してください。
細かすぎる補足
- (*注1)たとえば、
とすれば反応式自体は成立します。しかし水溶液中で は とくっついて になるので、 がさらに起こったとすれば最終的な半反応式と一致します。つまり は酸素を受け取る役割があるとも言えるわけです。(もちろん本当に が発生するというわけではないです。) - (*注2)注1の裏を返すと、酸性でなければ酸素を受け取る
が足りないということになります。よって中性・塩基性では代わりに が酸素を受け取って になります。だから中性・塩基性で が登場するわけです。ただし、反応式を作るためだけなら1〜4の手順を機械的にやればOKです。 - 単に酸の
が酸素を受け取るのと、 で電離した上で が酸素を受け取るのでは、当然前者の方が楽そうですよね。そのイメージ通り、一般に酸化剤は酸性の方が強く働きます。単に反応の勢いが弱くなる場合もあれば、生成物自体が変わってしまう場合もあります。
【酸性】
関連動画








