酸化数
概要
「酸化数」とは、ずばり電子をどれだけ奪った/奪われたかの数のこと。物質内において、電子を引っ張る強さである電気陰性度がより大きい原子が、電子を奪い取ったと仮定したときの電荷のことです。
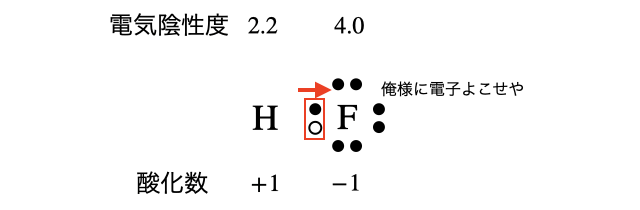
マイナス電荷を持つ電子を奪われるほど酸化数がプラスの値になります。つまり酸化数が大きいほど電子不足なので「酸化剤(=他人から電子を奪うやつ)」になりやすいです。逆に電子を奪いすぎて酸化数が小さいほど「還元剤(=他人に電子を与えるやつ)」になりやすいです。
詳細
酸化数の定義
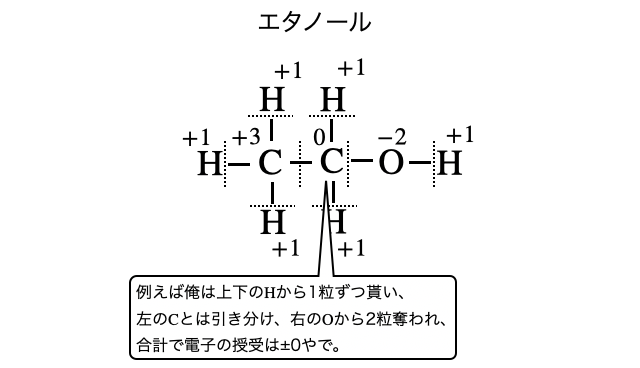
酸化数とは、電気陰性度が大きい原子に電子が帰属すると仮定したときの、その原子の電荷の大きさのことです(*注1)。もちろん物質中の全ての原子にそれぞれ個別に酸化数があることになります。
酸化数が大きい原子を含む物質ほど酸化剤として働きやすいです。たとえば、マンガン
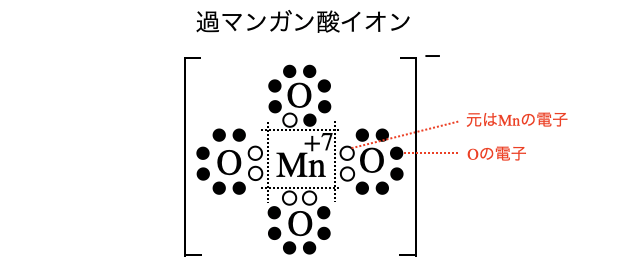
その結果、酸化数+7の過マンガン酸イオン
このように、酸化数がわかるとどんな反応を起こしそうかが大まかにわかります(*注2)。
酸化数の計算方法
定義に則して考えるなら、
- 物質の構造式を書く
- 各結合の電子対を電気陰性度の大きい側に帰属させる(同じ原子間では引き分け)
- 各原子における電子の増減を数える
の手順で酸化数を計算可能です(*注3)。「電気陰性度」で勉強した電気陰性度の大まかな大小関係、
より楽な計算方法
ただし毎回構造式を書いて電気陰性度を書いていたらすぐに化学を嫌いになります。以下の手順で考えれば、機械的に酸化数を計算することができます。
- 単体中の原子の酸化数は0
- 水素
は+1、酸素 は-2 - アルカリ金属は+1、ハロゲンは-1
- 化合物を構成する全原子の酸化数の総和は0、イオンを構成する全原子の酸化数の総和はイオンの価数と一致
このルールに出てこない物質の酸化数を
なぜこれで求まるかは補足(*注3)で言うとして、入試で出題される物質のほとんどはこの方法で計算できます。ただし例外として過酸化水素
例
(1)二酸化炭素

(2)炭酸水素ナトリウム
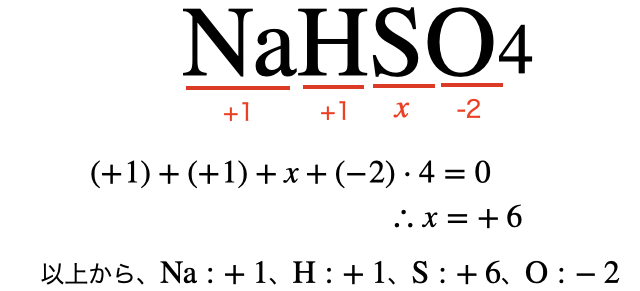
(3)銅

(4)硝酸イオン
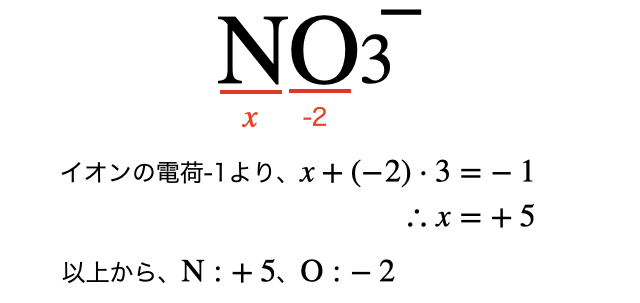
(5)過酸化水素
例外の過酸化水素は
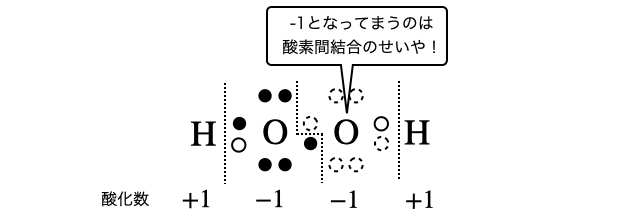
補足
- (*注1)イオン結合も全て共有結合と仮定して考えます。たとえば
は本当は組成式ですが、 という分子式のように捉えて考えます。 - (*注2)このように酸化剤・還元剤が電子を奪う・奪われるようすを書いたイオン反応式を「半反応式」といいます。詳しい式の作り方は「酸化還元反応」をチェック!
- (*注3)1、4は定義から当然です。単体は電子を奪われないから0、化合物中の原子はお互いに電子を授受しているだけなので±0です。次に2、4は正直"勘"です。電気陰性度的に、酸素とハロゲンはどうせ電子を奪う、アルカリ金属はどうせ電子を奪われる、と言う感じ。なんか雑な感じもしますが、実際だいたいこれでどうにかなります。ただこの雑さを見れば
のような例外が生まれるのは当然とも思えますね。
関連動画









