水素原子のスペクトル
水素原子のスペクトル
物質を高温に熱すると、物質を構成する原子や分子が振動し、電磁波つまり光が出される。
このとき、一般に高温の個体や液体が出す光のスペクトルを調べると、波長が連続的に分布するが(これを連続スペクトルという)、高温の気体が出す光のスペクトルは、波長がとびとびに分布する(これを線スペクトルという)。
※ スペクトルとは、光をいろんな波長に分けたもの。光の分散の用語も復習しよう。
そこで、最も簡単な原子である水素原子の線スペクトルを考えると、とびとびに現れる波長には実は規則性が存在し、水素原子の線スペクトルの波長
ただし、
という自然数である。この
嫌悪感を感じる見た目をしているが、この式の見方が重要で、
水素原子のスペクトルは実際には下図のようになっており、これがなんと見事に、上の公式で実際に
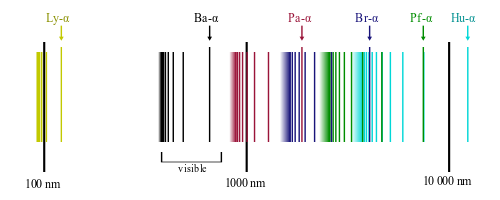
(確かにとびとびに分布している点に注目しよう。また、横軸は対数になっているので、手持ちの教科書の図とは間隔が違うかもしれない)
図で色が分かれている通り、
:ライマン系列(上の図の Ly に該当) :バルマー系列(上の図の Ba に該当) :パッシェン系列(上の図の Pa に該当)
※ 誤りの例:ライマー系列、バルマン系列、パッション系列
教科書には上の3つしか載っていないが、気になって眠れない人向けに、その後の系列名も紹介する(こっちは覚えなくてOK)。
:ブラケット系列(上の図の Br に該当) :プント系列(上の図の Pf に該当) :ハンフリーズ系列(上の図の Hu に該当)
背景
もともと、この式が生まれるきっかけとなったのは実はバルマーという中学校の先生であった。
バルマーさんは、実験を通じて水素原子のスペクトルの中の4本の線を観測し、それらの波長の規則性を発見した。(この4本は、現在はバルマー系列に含まれるもの。なので名前がついてる)
「4本だけ?」と思うかもしれないが、上の図にあるように、バルマー系列は可視光線の波長帯と重なっており、観測しやすかったのかもしれない。
その後、バルマーが見つけたものよりも波長の短いものや長いものも発見され、リュードベリによって一般化されたのが上の公式である。(バルマーが見つけた規則性は、
理由
では、「なぜスペクトルがとびとびになるのか」「なぜこんな式が成り立つのか」という疑問が生まれてくる。
これについては、ボーアという別の物理学者が、ボーアの原子模型という新しいモデルを提唱し、1913年に水素原子のスペクトルの式を導くことに成功した。詳しくはエネルギー準位の用語で解説しているので見てみよう。
(画像のクレジット)
OrangeDog, CC 表示-継承 3.0, https://commons.wikimedia.org/w/index.php?curid=6278485による
この用語を含むファイル
関連動画
関連用語




