ヨウ素還元滴定(ヨードメトリー)
概要
「ヨウ素還元滴定(ヨードメトリー)」とは、ヨウ素
滴定の手順は以下の通り。
- 濃いめ多めの
水溶液に量を知りたい酸化剤を加える - 1で生じた
を で滴定する - 以下の関係から酸化剤の量がわかる
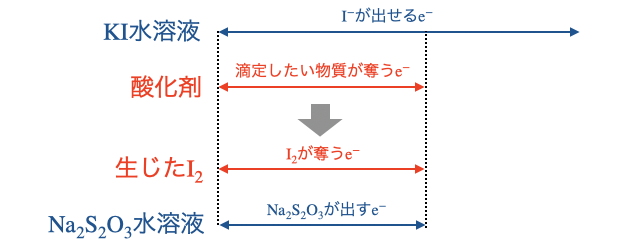
反応の終点を見極めるのにヨウ素デンプン反応を使うため、工夫して考えられた滴定方法です。
詳細
ヨウ素滴定とは
ヨウ素
ヨウ素を酸化剤として使い還元剤を滴定する方法を「ヨウ素酸化滴定(ヨージメトリー)」、ヨウ素を還元剤として使い酸化剤を滴定する方法を「ヨウ素還元滴定(ヨードメトリー)」といいます。
ここでは後者の説明です。
ヨウ素還元滴定の手順
- 濃いめ多めの
水溶液に量を知りたい酸化剤を加える - 1で生じた
を で滴定する - 以下の関係から酸化剤の量がわかる
それぞれ詳細に見ていきます。
(1)
少し濃いめ多めに用意した
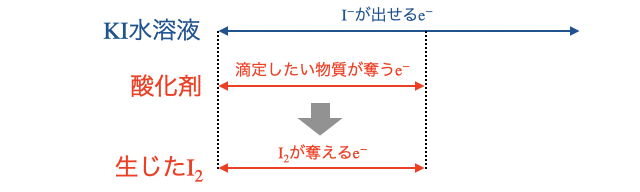
(2)生じた
生じた
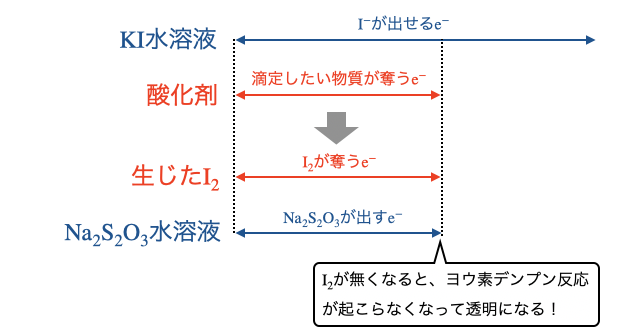
(3)酸化剤の量を計算する
以上を踏まえて酸化剤の量を計算します。酸化剤を一旦

上の図から、(最初の
例

のように、1粒に対して電子2粒を奪うので、
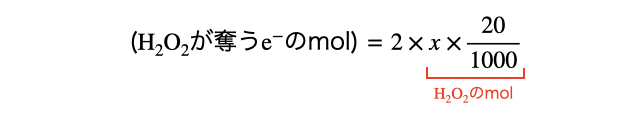
次に、
還元剤
のように、2粒に対して電子2粒、つまり1粒に対して電子1粒を奪うので、
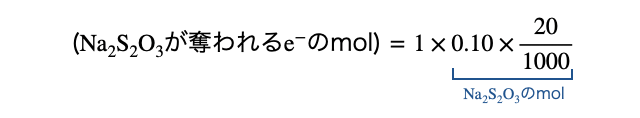
以上より、
補足
- (*注1)こんな面倒なことせず、酸化剤を直接
水溶液で滴定すればいいんじゃね?と思うかもしれませんが、それでは反応の終点がわかりません。間にヨウ素を挟むことで、ヨウ素デンプン反応を利用することができます。
この用語を含むファイル
関連動画
関連用語




