ヨウ素酸化滴定(ヨージメトリー)
概要
「ヨウ素酸化滴定(ヨージメトリー)」とは、ヨウ素
滴定方法は「逆滴定」とほぼ同じです。
水溶液に多めに を溶かす - 量を知りたい還元剤(
など)を吸収させる - 余った
を で滴定する - 以下の関係から還元剤の量がわかる
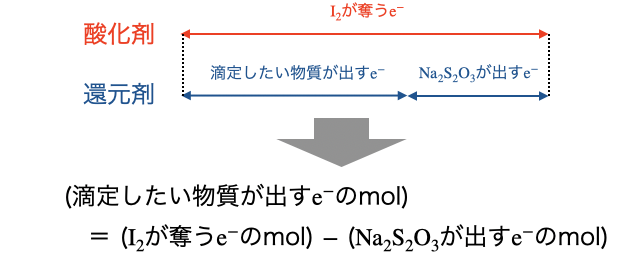
詳細
ヨウ素滴定とは
ヨウ素
ヨウ素を酸化剤として使い還元剤を滴定する方法を「ヨウ素酸化滴定(ヨージメトリー)」、ヨウ素を還元剤として使い酸化剤を滴定する方法を「ヨウ素還元滴定(ヨードメトリー)」といいます。
ここでは前者の説明です。
ヨウ素酸化滴定の手順
水溶液に多めに を溶かす - 量を知りたい還元剤(
など)を吸収させる - 余った
を で滴定する - 計算によって還元剤の量を求める
それぞれ詳細を見ていきます。
(1)ヨウ素溶液の準備する
無極性分子であるヨウ素
ヨウ素溶液は濃度を測って調製しておきます。ちょっと多めに作っておくイメージです。
(2)(1)に還元剤を吸収させる
量を知りたい還元剤を(1)の溶液に全て吸収させます。ちょっと要素溶液はちょっと濃いめ・多めに作ってあるので、一部の

(3)余った
余った
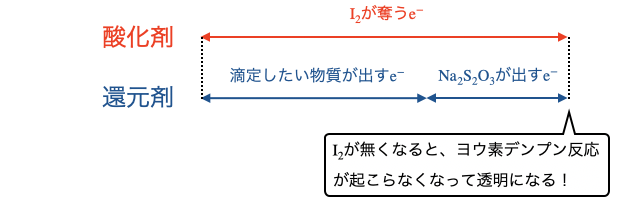
(4)還元剤の量を計算する
(1)〜(3)の実験を踏まえて還元剤の量を計算します。

例

単純な話、(酸化剤が奪った電子数の合計)=(還元剤が放出した電子数の合計) というだけの話です。まず今回登場する物質の半反応式は以下の通り。
酸化剤
還元剤
つまり、1粒の
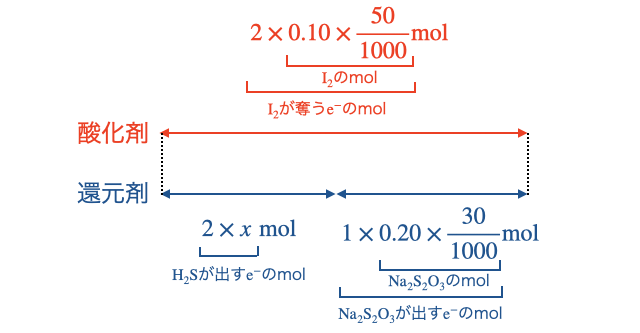
よって、
補足
- ただよび理系チャンネルさん・受験メモ山本・かないTeachannelさん・化学好きの東工大生かずきさんなどの動画もチェック!
この用語を含むファイル
関連動画





関連用語