電子親和力
概要
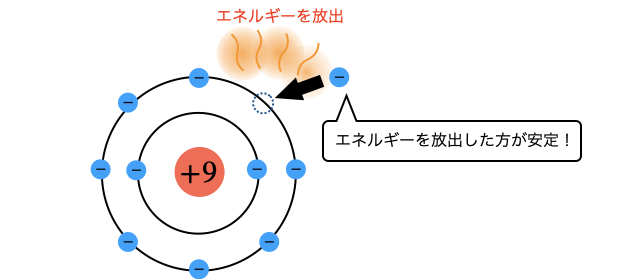
「電子親和力」とは、粒子が電子を受け取るときに放出するエネルギーのこと。一般にエネルギーは放出する方が安定なので、電子親和力が大きいほど電子が大好きというイメージです。
見た目が似た言葉に「電気陰性度」があります。意味も少し似ていますが地味に重要な違いがあるので、曖昧な人は電気陰性度のページも確認しておきましょう。
詳細
電子親和力とは
電子親和力とは、"どれだけ電子と親和したいか"という値です。もっと雑に言えば電子がどれだけ好きかという値です。つまり電子親和力が大きい原子ほど陰イオンになりやすいです。
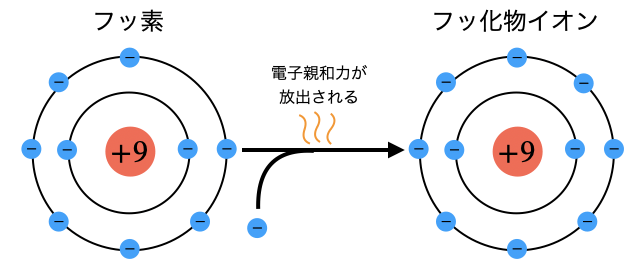
電子親和力の大小
周期表の右上の元素ほど電子親和力が大きい傾向にあります。つまりたとえば周期表右側のハロゲンは陰イオンになりやすく、左側のアルカリ金属は陰イオンになりにくいと言えます。
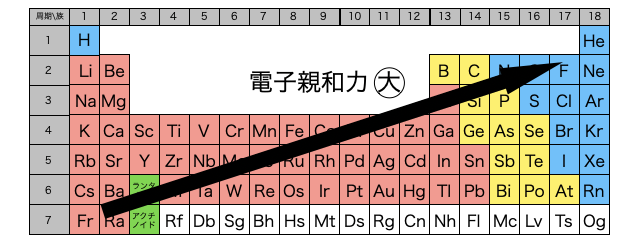
理由はほぼ「イオン化エネルギー」の大小と同じですが、もしかしたら物理が得意でないとイメージが難しいかもしれません。ここの理由はとりあえず曖昧でもいいですよ。
同じ周期では周期表の右側ほど陽子数が多く、原子核が電子を引っ張る力が強くなります。つまり、たとえばボールが重力に引っ張られて地面に張り付いていた方が安定なように、電子もより強い力で引っ張られる原子核に張り付いていた方が安定になります。だから右側ほど放出するエネルギーが大きい=電子親和力が大きいわけです。
同じ族では周期表の上側ほど原子半径が小さく、原子核が電子を引っ張る力が強くなります。あとは先ほどの説明と同様です。
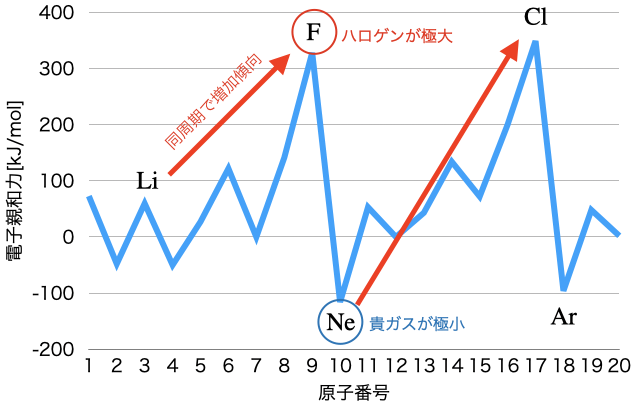
ちなみに、横軸を原子番号、縦軸を電子親和力としたグラフは以下の通り。
イオン化エネルギーとの関係
似た概念に「イオン化エネルギー」があります。イオン化エネルギーとは、電子を引っこ抜くのに必要なエネルギーのことです。電子親和力は電子を受け渡したときに内部から放出されるエネルギー、イオン化エネルギーは電子を引き抜くときに外部から加える必要があるエネルギーなので真逆の概念です。
補足
- 電子親和力については受験メモ山本の授業シリーズの中で詳しく説明しています。
- たとえば
の電子親和力はプラスなので、陰イオンになりやすいの?と思うかもしれませんがそこまで単純でもありません。 が電子を受け取るためには別の原子にイオン化エネルギーを加えて電子を引き剥がす必要がありますし、その後イオンが水和したり結合したりしてエネルギーを放出したりします。それらのトータルで実際に陰イオンになるかが決まります。 そんな中で元素内で相対的に電子親和力が小さい はやはり陰イオンになりにくいです(他の元素が優先的に陰イオンになります)。 - しかし
の電子親和力がプラスであることは確かなので、めちゃくちゃうまく工夫をすれば陰イオンを作れなくもないです。気になる人は放課後化学講義室さんの記事をチェック!
関連動画






