イオン結合
概要
「イオン結合」とは、陽イオンと陰イオンがクーロン力によって引き合う結合のこと。電子嫌いの金属が電子を捨てた陽イオン、電子好きの非金属が電子をもらった陰イオンによる結合です。
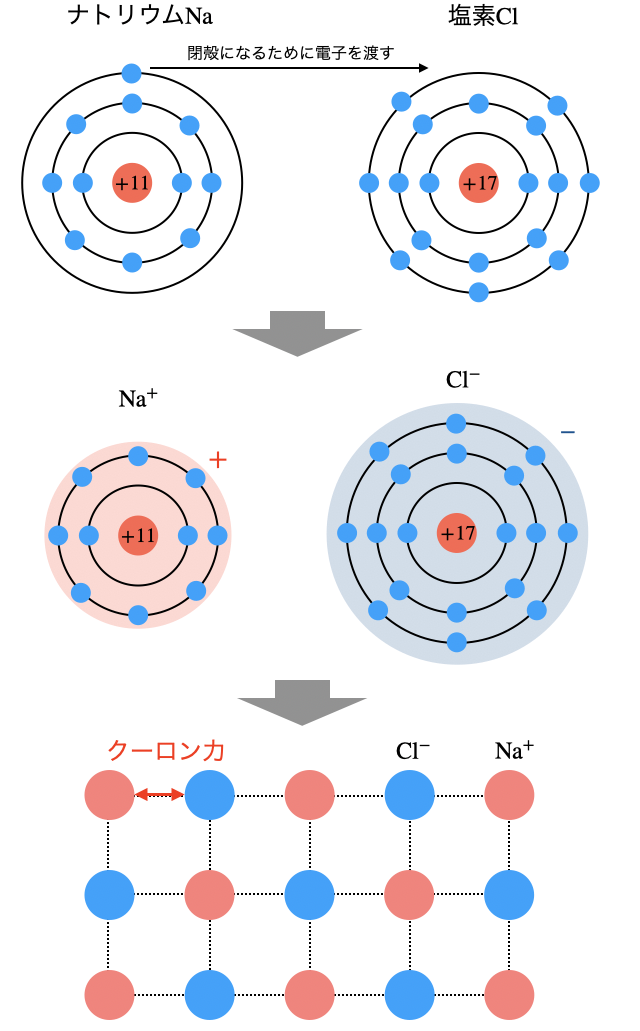
イオン結合によってできたイオン結晶は、
- 硬いが脆い
- 融点・沸点が高い
- 液体・溶液では電気伝導性が高い
などの性質があります。
詳細
性質
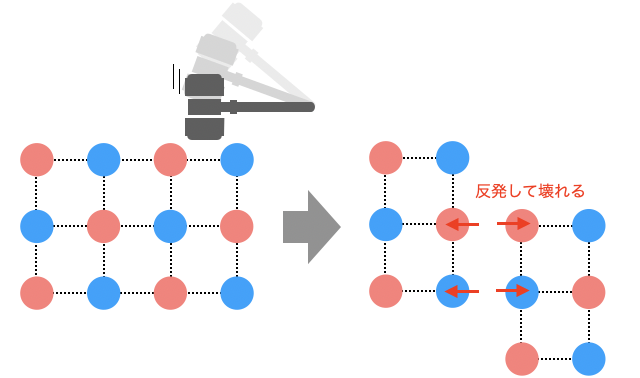
(1)硬いが脆い
クーロン力は比較的強い力なので、イオン結合は硬い結合になります。よってイオン結晶はかなり硬い結晶です。ただし、たとえば硬いガラスも衝撃を与えれば割れてしまうように、イオン結晶は硬い割には脆いという性質もあります。
イオン結晶に衝撃を加わって結晶が少しずれると、陽イオン同士・陰イオン同士が隣り合ってしまい、逆にクーロン力によって強く反発してしまいます。だから脆くなってしまうわけです。
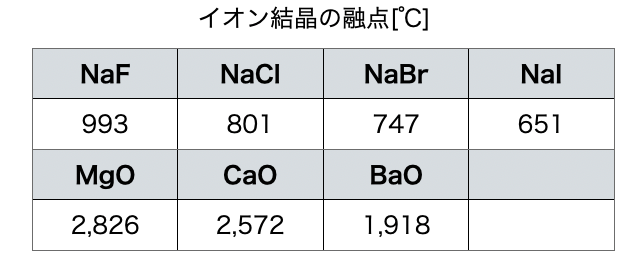
(2)融点・沸点が高い
同様の理由で、結合が強いため融点・沸点が高いです。特に、イオンの価数が大きいほど・イオン半径が小さいほど高くなる傾向にあります(*注1)。
(3)液体・溶液では電気伝導性が高い
めちゃくちゃ加熱してドロドロの液体にしたり水に溶かしたりすることで、電気伝導性が非常に高くなります。電圧を与えると電子の代わりに電荷を帯びたイオンが移動することで電流が流れるイメージです(*注2)。
ちなみに、普通電荷が偏った状態は不安定なので、たとえばイオンが気体として飛び回るのは不安定です。しかしイオンが水の中に入ると、極性分子である水に水和されることで安定に存在できます。このように水に入れると電離し水和されて溶ける物質を電解質といいます。
補足
- (*注1)クーロン力
は電気量 、 、電荷の距離 、定数 を使って と表せます。だから電荷が大きく距離が近いほど大きな力になり、融点・沸点が高くなるわけです。 - (*注2)イオンが移動を続けると、どんどんイオンが一箇所に溜まりまくってしまいそうにも思いますよね。しかし実際には「電気分解」が起こることで電荷が偏ることはありません。
関連動画

13:56
化学結合①〜イオン結合〜【化学基礎#15】ここみらいチャンネル

10:14
高校化学解説講義:「イオン結合」講義6物理の醍醐味を味わうチャンネル

8:35
【イオン結合とイオン結晶って何が違うの!?】この動画で解決!化学結合と結晶の違いと結晶の見分け方!!〔現役塾講師解説、高校化学、化学基礎、2022年度版〕3rd School

15:51
【これで得意になれます!】イオン結合とイオン結晶を簡単に理解!&組成式が得意になる3ステップの伝授!〔現役塾講師解説、高校化学、化学基礎〕3rd School

7:52
【化学基礎】 物質の構成43 結合と物質の分類 (8分)映像授業 Try IT(トライイット)
関連用語