電池
概要
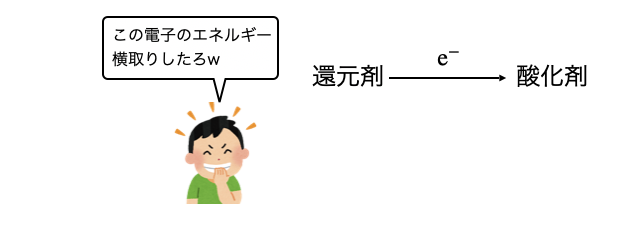
「電池」とは、酸化還元反応を利用して電気エネルギーを取り出す装置のこと。還元剤が酸化剤に電子を受け渡す酸化還元反応にズカズカ割り込んで、電子のエネルギーだけ横取りする装置です(言い方)。
最も簡単な電池は、電解液に正極と負極を刺し、電極同士を導線で繋いで作ります。正極では酸化剤・負極では還元剤が反応を起こすことで、負極→正極に電子を送ります(=正極→負極に電流を流す)。またそれぞれの電極で実際に酸化剤・還元剤として働く物質を、それぞれ正極活物質・負極活物質と言います。
また充電不可の電池を一次電池、充電可能な電池を二次電池と言います(*注1)。
詳細
仕組み
普通の酸化還元反応では熱エネルギーなどとして消費されていたエネルギーを、電気エネルギーとして取り出すのが電池です。そのために、酸化剤と還元剤を離れた場所におき導線をつなぐことで、糸電話のように導線を通して電子のやりとりを強要します。
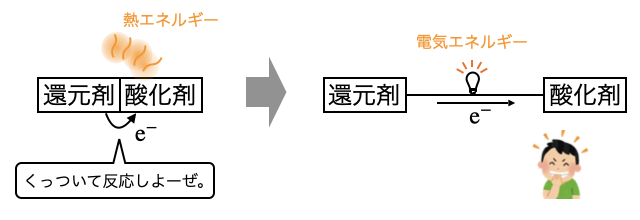
ただ電子をただ送るだけでは電荷が偏ってしまうので、電荷調整用に電解液に電極をつけます。電解液には陽イオンと陰イオンがあるので、酸化還元反応が進んでもイオンが移動することで電荷の偏りは解消されます。
以上のように、酸化剤と還元剤をリモートワークさせ、その労働力を人間が奪い取る装置が電池だということです。
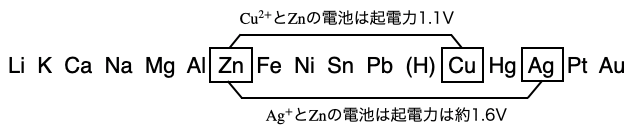
イオン化傾向との関係
電池では、正極活物質(酸化剤)と負極活物質(還元剤)にイオン化傾向の差がある金属を利用することがよくあります。たとえば最も簡単な電池の1つである「ダニエル電池」では、正極活物質として
このような反応を利用するとき、金属同士のイオン化傾向の差が大きいほど、大きな起電力の電池を作ることができます。
電池の種類
大学入試で重要な順に並べます。とりあえずは鉛蓄電池まで、余裕があればマンガン乾電池までを理解しておけばOK。あとは参考書や過去問で登場したときにそのたび確認していきましょう。
- ダニエル電池
- ボルタ電池
- 鉛蓄電池
- 燃料電池
- アルカリマンガン電池
- ニッカド電池
- リチウムイオン電池
- ニッケル水素電池
- リチウム電池
- 酸化銀電池
- レドックスフロー電池
などなど。
補足
- この記事の著者は特に電池に恨みがあるわけではありません。
- (*注1)充電の仕組みは「鉛蓄電池」などの二次電池の記事をチェック!
関連動画







