反応速度式
概要
「反応速度式」とは、化学反応のスピードを計算する式のこと。たとえば、
のように濃度のかけ算で表します。
一般には、
のように表せます。このときの比例定数
詳細
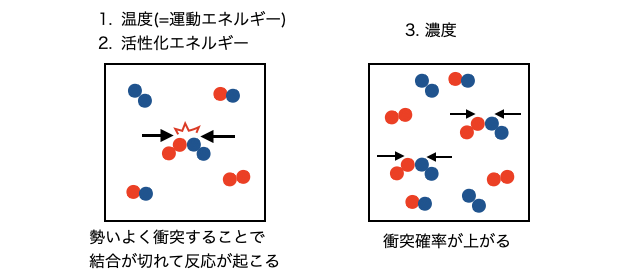
反応速度が決まる要因
メタンが燃える爆発的な反応や鉄が錆びるゆっくりした反応など、化学反応は種類によってスピードが違います。化学反応は、
- 温度が高く粒子のスピードが速いほど
- 活性化エネルギーが小さいほど
- 濃度が高く粒子の衝突確率が高いほど
スピードが速くなります。
化学反応は、粒子同士がバコーンとぶつかることで起こります。このときの運動エネルギーが、活性化エネルギーを超えることができれば反応が起こるので、温度が高く、活性化エネルギーが小さいほど反応が起こります。また、濃度が高いほど衝突の確率が上がるのでさらに反応速度が大きくなります。
反応速度式
ある温度と活性化エネルギーに対して、濃度ごとの反応速度を表した式が「反応速度式」です。たとえば
まずは正反応から。結論から言えば、普通に考えれば正反応の速度
この場合、比例定数を
しかし実は必ずしも以上が正しいとは限りません。なぜなら、実際に化学反応をスローモーションで見ると、ただただ衝突して起こるよりも複雑な現象が起こっていることも多いからです(*注2)。詳細は素反応で説明してここでは省略しますが、とにかく、濃度のかけ算っぽく書けることも多いけど実際には実験して確かめてみないとわからないということです。
逆反応についても同様に考えれば、逆反応は2粒の
以上を一般化すると、
のように表せ、
反応次数と反応速度定数の決定
先ほど説明した通り、反応次数は実験によって決まる値です。また比例定数である反応速度定数も実験によって求まります。その測定方法に関しては「反応速度定数」の辞書で詳しく説明します。
補足
- (*注1)ちなみにここでは濃度のみに注目していますが、実際には
は温度と活性化エネルギーに依存しています。 - (*注2)「複雑な現象」について、例え話で考えてみましょう(以下は仮定の話と思ってください)。
たとえば、
が熱などにより 原子2粒に分解され、それが にぶつかることで となるとします。このときさらに、 が分解するのに時間がかかるけど、一度分解してしまえば即座に に攻撃するとしましょう。 するとどうせ前者の反応に時間がかかり、後者はそれに比べて一瞬で反応するんだから、全体の反応速度はほぼ前者の反応速度に等しくなります。そして前者の反応 の速度は に比例するので、全体の反応速度も に比例することになります。この仮定の場合は は関係なくなるわけです。 以上のように反応の仕組みによって濃度の関わり方が変わるので、反応速度式は実験によって決まる式ということになります。
関連動画
関連用語





