アニリン
概要
「アニリン」とは、ベンゼン環にアミノ基-
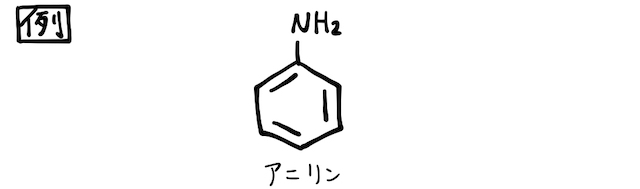
アンモニアに似ていることからわかるように、アニリンは弱塩基性を示します。またアニリンは酸化されやすく、強酸化剤
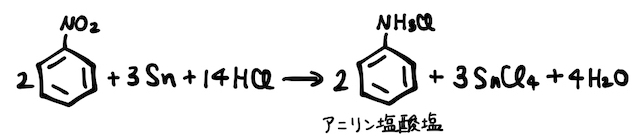
ニトロベンゼンを塩酸中でスズや鉄で還元することでアニリン塩酸塩が得られ、これを弱塩基遊離することでアニリンが得られます。
詳細
アニリンの反応
(1) 塩基としての反応
アンモニアの水素1つがベンゼン環となった構造のアニリンは、アンモニアと同様に弱塩基として働きます(*補足2)。非共有電子対に
(2) アニリンの酸化
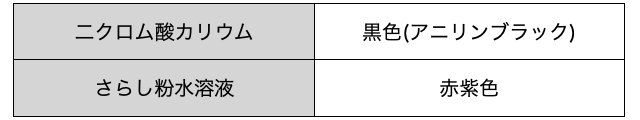
アニリンは、窒素の酸化数が小さいことからイメージできるように、-

アニリンに、強酸化剤
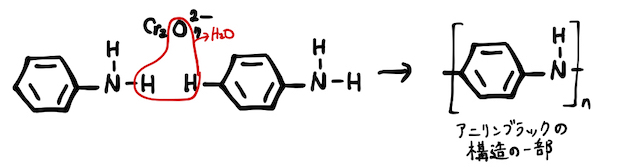
同じく酸化作用を持つさらし粉水溶液を加えると赤紫色を呈色します。こちらも色だけでいいので覚えておきましょう。
(3) アミド化
アニリンに無水酢酸を加えると、アミド結合ができるアミド化(アセチル化)が起こります。
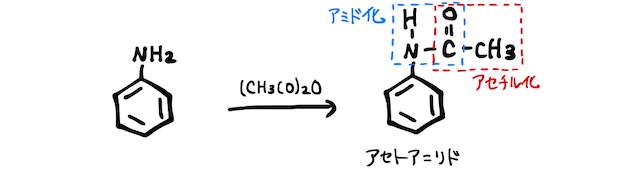
-
(4) ジアゾ化・カップリング
アニリンに、低温で亜硝酸ナトリウム
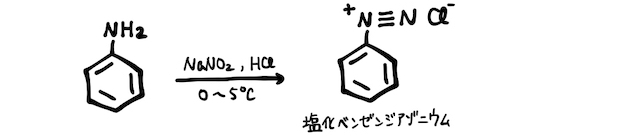
ここにナトリウムフェノキシドを加えると、陽イオンであるベンゼンジアゾニウムイオンが置換反応を起こし、綺麗なオレンジ色のp-フェニルアゾフェノール(またはp-ヒドロキシアゾベンゼン)が得られます。
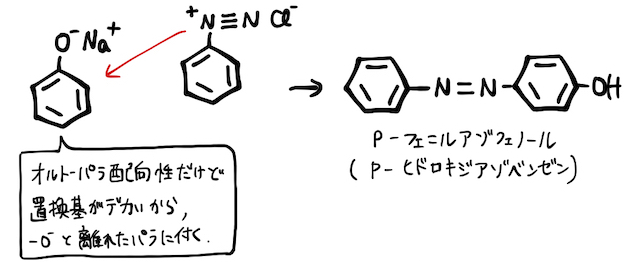
より詳しい仕組みは「ジアゾ化」の辞書を確認してみましょう。
アニリンの製法
ベンゼンの誘導体の多くは、陽イオンが攻撃する置換反応で作ることができました。しかし、
そこでアニリンは、ニトロベンゼンの還元によって作ります。まずはニトロ化によってニトロベンゼンを作ります。
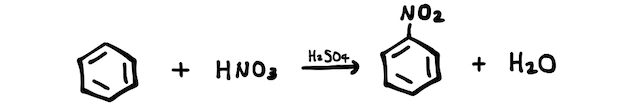
続いて、窒素の酸化数が+3であるニトロ基-
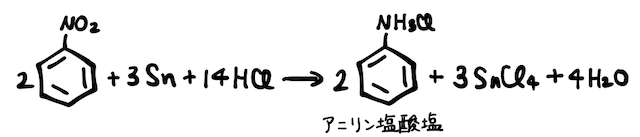
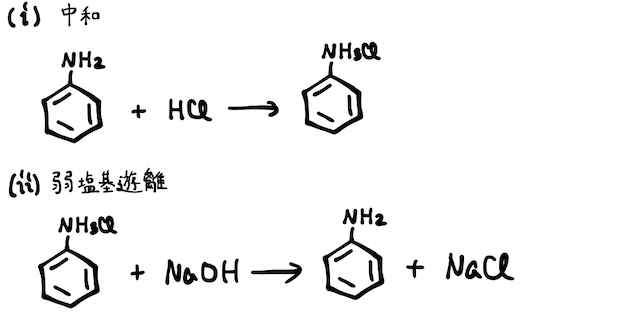
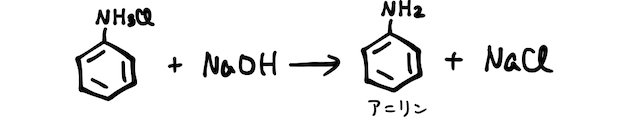
最後に、得られたアニリン塩酸塩に強塩基を加え、弱塩基遊離反応を起こすことでアニリンが得られます。
補足
- (*補足1)正確には、-
の水素を炭化水素に置換した形も含めてアミノ基と呼びます。が、大学受験では特に気にしなくていいです。 - (*補足2)アニリンが-
に持つ非共有電子対は、ベンゼン環にひっぱられて非局在化(共鳴)されます。よって、アンモニアよりも弱い塩基となります。 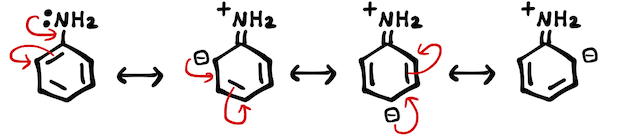
- (*補足3)反応式は、酸化還元反応の反応式の作り方で作ることができます。ちなみに、スズ
以外に鉄 でも反応でき、工業的には安価な鉄を使う方が主流です。反応の詳細な過程に注目すると、 は+2と+4、 は+2と+3と2通りのイオンになれるので反応が開始できます。
関連動画






