電気分解
概要
「電気分解」とは、電圧をかけて無理やり酸化還元反応を起こす方法のこと。本来、自然に起こる酸化還元反応の逆反応を、電池のエネルギーで無理やり起こします。
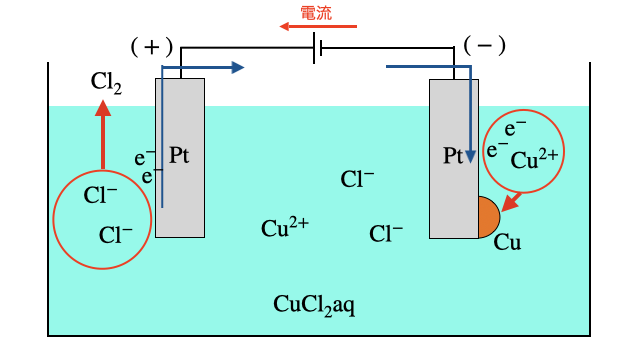
水溶液に電極をさして電池をつなげることで電気分解を行います。電池の正極が繋がれた電極を「陽極」、負極が繋がれた電極を「陰極」といいます。正極から電子を吸い取られる陽極では酸化反応が、負極から電子を送り込まれる陰極では還元反応がおきます。
詳細
電気分解とは
原則、金属は電子を捨てる還元剤に、ハロゲンは電子を奪う酸化剤になりやすく、たとえば加熱した
一方で、
半反応式を反応式にすれば、
という反応がおきます。このように外部からエネルギーを加えることで本来起こるのと逆向きの反応を起こすのが電気分解です。もう少し具体的に図を使って確認しておきましょう。

電池の正極が繋がれるのが陽極、負極が繋がれるのが陰極です。上図で言えば電流は左向きなので、逆に電子は右向きに移動しています(*注1)。つまり陽極では電子が奪われ、陰極では電子を押しつけられます。
陽極の酸化反応
電気分解では電池のエネルギーで無理やり電流を流させられているので、陽極では誰かが電子を奪われる役目をする必要があります。電極と水溶液の種類によって反応する物質が変わります。
1. 電極の金属 金属は原則電子を捨てて還元剤として働きたいものです。よって電極が溶け出して電子を奪われます。
ただし、イオン化傾向の小さい
2. 水溶液中の陰イオン 電極が反応できない場合、水溶液中の陰イオンが電子を奪われます。まあ陰イオンは電子を余分に持ってるから確かに反応できそうです。
(後者は強塩基性で
ただし、
3.最終手段の水 1も2もダメなら最終手段として水が反応します(*注2)。
陰極の還元反応
陽極とは逆に、電子を無理やり押しつけられるのが陰極です。
1. 水溶液中の陽イオン 水溶液中の陽イオンが電子を受け取ります。
(3つ目は強酸性で
ただし、
2.最終手段の水 陽イオンがダメなら水が反応せざるをえません。
応用
電気分解を利用した技術に以下のようなものがあります。
それぞれ無機化学で重要な内容です。
補足
-
受験メモ山本・ただよびベーシック理系さんなどの動画もチェック!
-
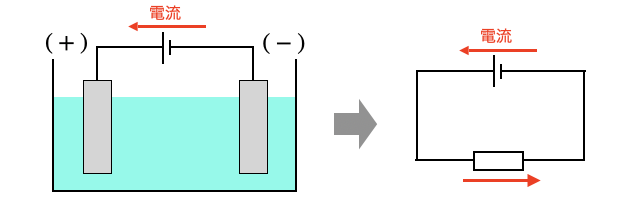
(*注1)電気分解の図を回路で書くなら以下の通り。電流は+から-に流れるから、図の左向き(反時計回り)ですね。
-
(*注2)電極での反応式は「半反応式の作り方」通りに作れます。たとえば
が電子を奪われるとき、酸化数+1の は電子を持っていないので酸化数-2の が奪われるしかなく、 と反応するはずです。反応物と生成物さえわかれば後は手順通りに半反応式を作れます。 -
陰極の反応について、イオン化傾向が中くらいの
や などのイオンは、一部反応して析出しながら同時に水も反応したりと複雑な現象がおきます。だから や などイオン化傾向が小さければ析出、 や などイオン化傾向が大きければ析出しない、それ以外は大学入試では出ない、でOKです。
この用語を含むファイル
関連動画





関連用語
