イオン化傾向
概要
「イオン化傾向」とは、溶液中で金属がどれだけ陽イオンになりやすいかの傾向のこと。陽イオンになるとき電子を放出する還元剤として働くので、還元剤の強さと考えることもできます。もっとラフに言えば電子を投げつける力の強さって感じ。
大学入試では以下のイオン化傾向を覚えておく必要があります。「リッチに貸そうかな、まああてにすんな、酷すぎる借金」という意味がわかりそうでわからない語呂合わせで覚えがちです。

イオン化傾向の違いによって、
- イオン化傾向大ほど反応性大
例:
などは水や空気と反応 - イオン化傾向小ほど反応性小
例:
は塩酸に溶けない - 金属同士で酸化還元反応を起こして電池を作る
例:
などの性質が生じます。
詳細
イオン化傾向とは、溶液中でどれだけ金属が陽イオンになりやすいか、どれだけ電子を放出しやすいかの傾向のことです(*注1)。覚えておきたいイオン化傾向は以下の通り。この並びは、より厳密な定義から計算されたものですが、大学入試では必死に覚えるしかありません。

語呂合わせは、リッチ・貸す・あてにする・酷い・借金のように、なんとなく関係しそうな単語で作られてはいますが、よく考えると全く意味がわかりません。しかし語呂合わせとはそんなもんです。
金属の反応性
イオン化傾向が大きいほど、つまり先ほどの図の左側ほど、他人に電子を押し付ける力が強く反応性が大きいです。よって左側の元素ほどいろいろな物質と反応することができます。たとえば
以上のような違いを、水・空気(酸素)・酸との反応についてまとめたのがした図です。常温の水であれば、
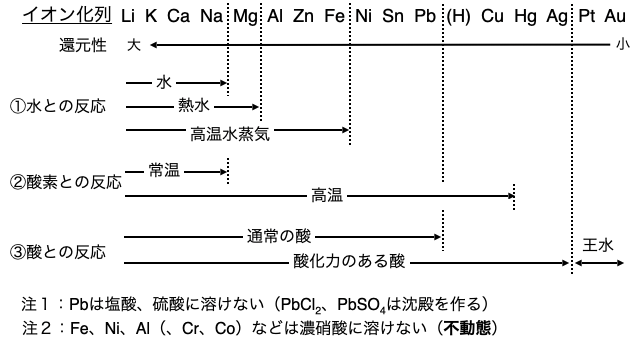
何がどこまで反応するかは覚えるしかありません。ただ
電池
この酸化還元反応をうまいこと利用するのが「電池」です。詳しくはリンク先の説明をチェック!
補足
- ただよびベーシック理系さん・受験メモ山本・かないTeachannelさんなどの動画もチェック!
- (*注1)そう聞くと「イオン化エネルギー」と似ていますね。イオン化エネルギーは気体状態の原子から電子を引き抜くときのエネルギー、イオン化傾向は溶液中での電子の放出しやすさを比べたものという違いがあります。ゴリゴリの理論的な計算では前者が便利ですが、ざっくり実際の溶液中での化学反応を考えるには後者が便利です。
関連動画








