ボルタ電池
概要
「ボルタ電池」と、正極の
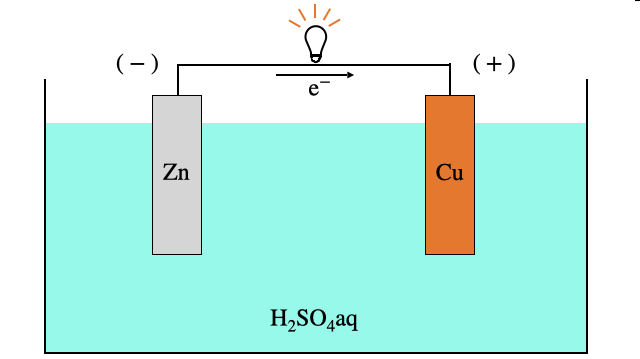
正極活物質は
詳細
仕組み
ボルタ電池は、
という酸化還元反応を利用した電池です。こいつが電池として働く仕組みは以下の通り。
1.
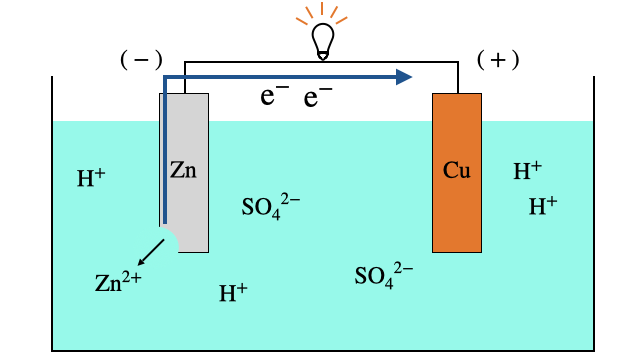
2.
導線からやってきた電子を正極の表面で
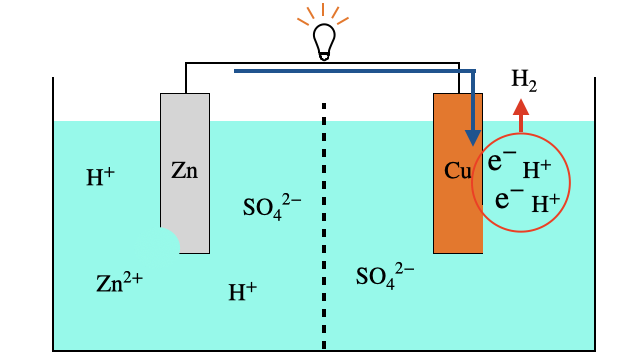
このときに導線を流れる電子のエネルギーを利用します。
問題点
1.
リモートで酸化還元反応を起こすのが電池の基本の仕組みですが、ボルタ電池では
浸してるだけで電極が溶け続ける電池はもちろん使い物になりません。その後このような問題点を踏まえて、正極活物質と負極活物質を素焼き板で仕切った「ダニエル電池」などの新型が開発されていきます。
2. 分極が発生する
ボルタ電池では、理論値よりも実際の起電力が小さくなる「分極」という現象が起こります。希硫酸に電極を浸した瞬間は、正極の表面にあるわずかな
この現象の原因は、
ちなみに正極の
3. 「減極剤」
過酸化水素水などの酸化剤を加えると分極が解消されるため、この酸化剤を減極剤と呼んでいた過去もありました。しかし、酸化剤を加えるとは単に負極活物質を
実際、ボルタ電池に過酸化水素水を加えると、起電力は0.76Vを超えてはるかに大きな値になってしまいます。
4. 気体の水素が生じる
最後に少しリアルな事情ですが、気体の水素が生じてしまう電池は電池として使いづらいです。スマホを使っていたら水素が溜まって爆発したら嫌ですよね(そんな事件もありましたが...)。
実際、たとえば「ニッカド電池」という電池では充電時に気体の酸素が生じる可能性があるため、その対処まで含めて電池が作られています。
補足
- (*注1)金属の表面の性質によってこのときのエネルギーが異なり、これを「水素過電圧」といいます。
は水素過電圧が小さく分極があまり起こりません。また分極の他の原因として、気体の水素が電極表面を覆ってしまい次の反応が妨げられる、なども挙げられます。
この用語を含むファイル
関連動画







