鉛蓄電池
概要
「鉛蓄電池」とは、正極の
正極活物質は
詳細
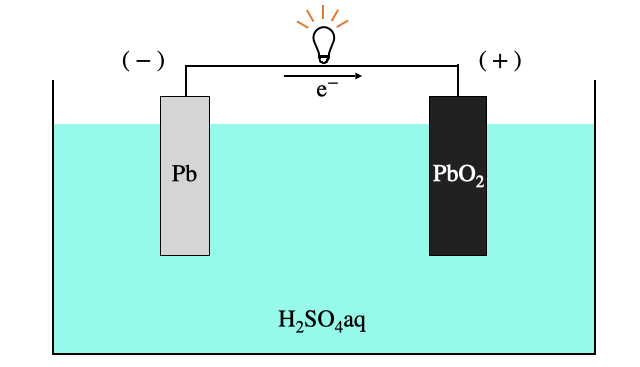
仕組み
同じ元素の鉛
結論から言うと各電極では、
全体では、
という反応が起こります。最初の説明の通り、負極・正極は酸化数+2の
となりそうなものです。しかし電解液が希硫酸であり
あとは基本的な電池の仕組みと同じように、負極から正極に電子を投げることで電池として働きます。
充電
鉛蓄電池に外部から別の電池をつなぐことで逆反応を起こし、充電をすることができます。
補足
- 鉛蓄電池の仕組みはNagira Academyさんの動画を、また鉛蓄電池で出題される計算問題はかないTeachannelさん・化学好きの東工大生かずきさん・ただよびベーシック理系さんなどの動画もチェック!
- ボルタ電池の問題点と同様に、電極を直接希硫酸に浸しているため負極の
は直接反応してしまいます。しかし は比較的イオン化傾向が大きいなどの理由で希硫酸とは超ゆっくりしか反応しないので、実用化が難しいほど大きい問題にはなりません。ただし、使っていない電池の容量が減少してしまう1つの原因にはなっています。
この用語を含むファイル
関連動画








