周期表
概要
「周期表」とは、元素を似た性質のものが並ぶよう原子番号順に並べた表のこと。化学の教科書のど頭に絶対載ってるあれ。
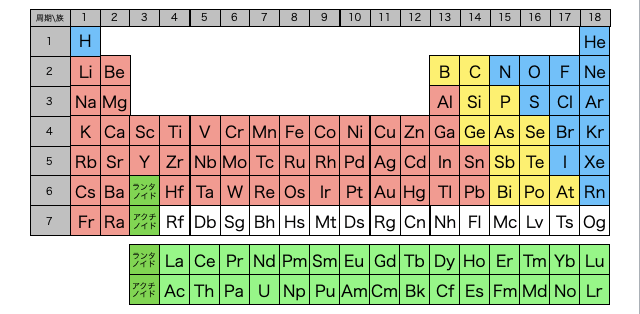
周期表の縦並びの列を「族」、横並びの行を「周期」といいます。慣れないうちはどっちがどっちか混乱しやすいので注意。また、たとえば周期表の左の列から順に第1族、第2族、...、上の行から順に第1周期、第2周期、... のように呼びます。
さらに同じ族に属する元素は「同族元素」といい、電子配置が似ているため性質も似ています。
詳細
族と周期
周期表は似た性質の元素が縦に並ぶようになっており、周期表の縦並びの列を「族」といいます。
たとえば、周期表の一番右端である第18族は「貴ガス」と呼ばれています。貴ガスたちはどれも化学反応をなかなか起こさないという性質があったりと性質がとても似ているので名前が付けられているわけです。他にも特徴的な性質を持つ族は名前がつけれてており、たとえば第1族は「アルカリ金属」、第2族を「アルカリ土類金属」、第17族は「ハロゲン」と呼ばれています。詳しくはいろいろ言いたいことあるから各ページに書くね。
また周期表の横並びの行を「周期」といいます。同族元素は性質が似ているのだから、下の行に下がっていくと似た性質の元素が周期的に現れるので周期と呼ばれているわけです。
族にはハロゲンみたいなかっこいい名前が付きがちですが、周期には特に名前がありません。第3周期、みたいにしか呼ばれません。不憫です。
電子配置との関係
歴史的には、ロシアの化学者メンデレーエフが似た性質の元素が縦に並ぶようにまとめたものが周期表です。しかし研究が進んだ現在では、元素の性質は電子配置によって決まることがわかっています。つまり周期表は電子配置を元に作られているとも言えます。
結論から言えば、最外殻がK殻の元素が第1周期、L殻の元素が第2周期、M殻の元素が第3周期、...、と並んでいます。そして同族元素の最外殻電子数が一致するようになっているため、同族元素は性質が似ているわけです。
ただし以上はざっくりした説明。電子配置に関する詳細は「電子配置」の説明をチェック!
周期表で見る元素の性質
周期表の右上の元素ほど陰性、左下の元素ほど陽性になりやすいです。つまり右上の元素ほど電子を受け取って陰イオンになりたがり、左下の元素ほど電子を捨てて陽イオンになりたがるということです。
同一周期では、右に行くほど原子番号=陽子数が大きく原子核の+が強くなるので、周囲の電子を引っ張る力が強くなります。また同一族では、上に行くほど原子半径が小さくなるので、周囲の電子を引っ張る力が強くなります。だから右上ほど電子を引っ張りやすく陰イオンになりやすいということです。
以上をより詳しく理解するためには、「イオン化エネルギー」「電子親和力」「電気陰性度」についても勉強しておきましょう。
補足
- 元素の種類は、化学基礎であっても20番の
まで、理系ならできれば第4周期最後の までは覚えましょう。あ、もちろん化学好き受験生なら118番まで言えて当然だよね?(ニッコリ) - かっきー&アッシュポテトの「スイヘイリーベ ~魔法の呪文~」を聞くことで多くの元素を覚えることができます。
この用語を含むファイル
関連動画









