ハロゲン
概要
「ハロゲン」とは、周期表の右から2列目の第17族元素たちのこと。フッ素
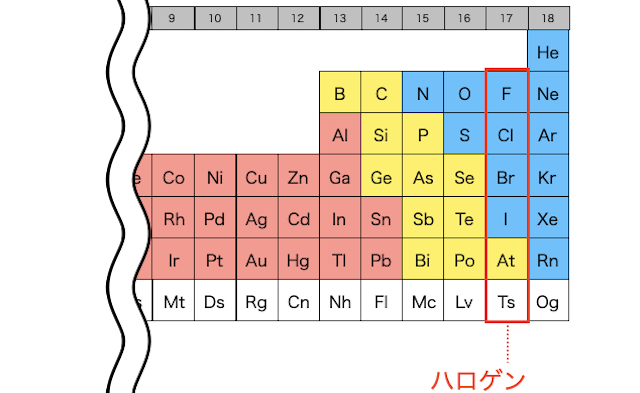
ハロゲンの性質をまとめると以下の通りです。やたら覚えることが多そうですが、「詳細」を読んでおくと結構ルールがわかってきますよ。
詳細
大学受験ではフッ素
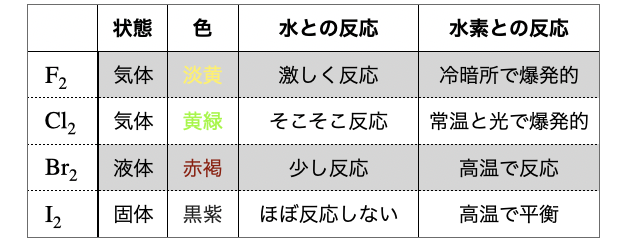
単体の物理的性質
(1)常温での状態
常温で
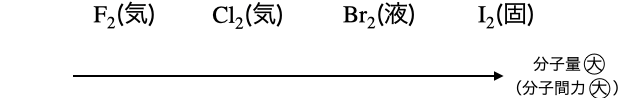
周期表の下の元素ほど原子量が大きくなり、分子量の大きい分子ほど分子間力が大きくなります。よって
(2)色
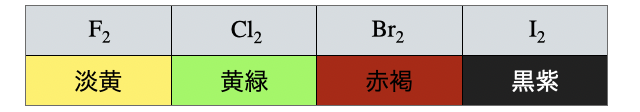
残念ながら受験において色は原則覚えるしかありません(泣)。何度も確認して即答できるようにしておきましょう。
単体の化学的性質
一般に周期表の右上の元素ほど電気陰性度が大きくなります。雑に言えば周期表の右側にあるハロゲンは電子が大好きだということです。よってハロゲンは全て酸化剤として働くことができます。また、ハロゲンの中でもさらに周期表の上側にあるものほど反応性が大きくなります。
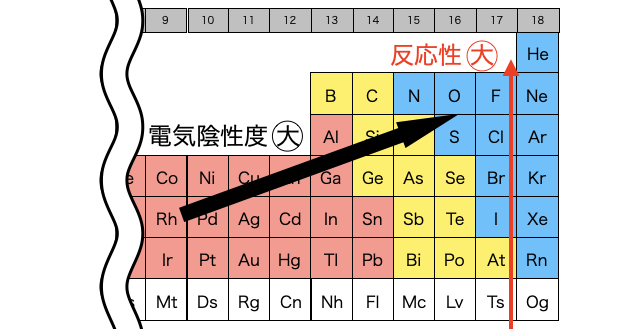
それではハロゲン単体の反応をいくつか確認しておきます。
(1)水との反応
フッ素
フッ素を除くハロゲンは酸素より電気陰性度が小さいため、酸素から電子を奪い去るほどの反応は起こらず以下の反応が起こります。周期表で上にある塩素ほど反応性は大きく、ヨウ素はほぼ反応しません。
(2)水素との反応
反応性の大小は水との反応で確認した通り。起こる反応も単純です。
(3)ハロゲン同士の酸化還元反応
反応性の大小関係からたとえば以下のような反応が起こります。
電気陰性度は
補足
- (*注1)呼ばれていません。
- 周期表でヨウ素の下にあるアスタチン
は不安定すぎて超希少な元素です。すぐに崩壊してしまうので詳しい性質は謎です。さらに下のテネシン は原子番号117の人工元素で半減期は余裕で1秒以下、性質なんてわかったもんじゃありません。 - 文中の(泣)ではiPhoneの黄色い顔の絵文字を使いたかったですが、このアプリの仕様上絵文字は使えなかったので泣く泣く妥協しています。
関連動画
関連用語





