酸化還元滴定
概要
「酸化還元滴定」とは、酸化還元反応を利用して物質の濃度や量を測定する手法のこと。中和滴定では(酸の
使う実験器具は「中和滴定で使うもの」と全く同じです。ただし、反応がぴったり終わる点をpH指示薬では測れないので、代わりに酸化剤か還元剤自体の色を利用するか、ヨウ素デンプン反応を利用するヨウ素滴定(ヨウ素酸化滴定・ヨウ素還元滴定)を行います。
詳細
酸化還元滴定の計算
未知の量の酸化剤(還元剤)に既知の量の還元剤(酸化剤)を反応させて、未知の量を計測するのが酸化還元滴定です。
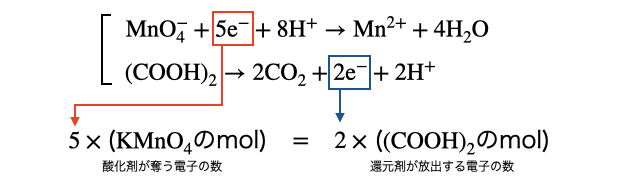
酸化還元滴定の計算は単に、還元剤が放出した分の電子を酸化剤が受け取る、と言う関係を式にするだけです。ただしそのためには半反応式を立てる必要があるので、 (1)酸化剤と還元剤の半反応式を作る (2)電子の数を比べる の2段階で計算できます。

(1)酸化剤と還元剤の半反応式を作る
作り方は「半反応式」をチェック!
(2)電子の数を比べる
1粒の
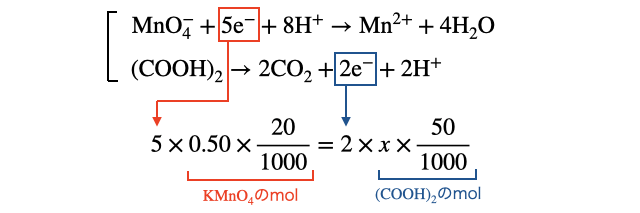
これを解けば
指示薬
ただし
補足
- 酸化剤の反応性を高めるために硫酸酸性としていますが、塩酸や硝酸を用いるとそれ自体がそれぞれ還元剤・酸化剤として働いてしまうので、原則硫酸を用いています。
この用語を含むファイル
関連動画
関連用語





