反応エンタルピー
(以下、新課程用なので注意!)
概要
エンタルピーという、エビタルタルみたいな少し可愛い言葉についての基礎的な理解を深めよう。
ここらへんは暗記しても応用が効かなくなるので、中身を理解するようにしよう!意外と、大したことは言っていない。
まず準備として、化学反応が起こり、観察の対象となる部分を系という(注目する物質をグループ化したようなもの)。系の熱を外に放出しながら進む反応を発熱反応、外の熱を系に吸収しながら進む反応を吸熱反応という。ここまではすぐに納得できるはず。
ここで、エンタルピーという、物質のエネルギーを表すようなものを考える。
ある反応が起こったときに、もとの反応物が持つエンタルピー(の総和)と、生成した物が持つエンタルピー(の総和)の差にあたるエネルギーは、外の世界と熱としてやりとりされることになる。(じゃないとエネルギーが保存されない)
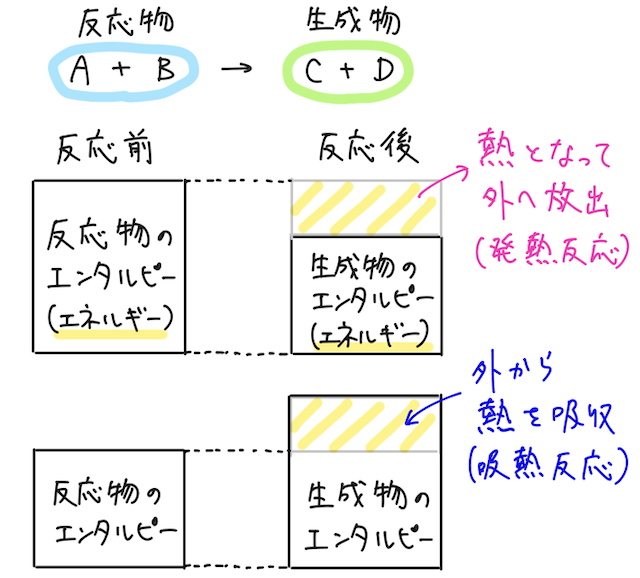
まずはここまでをしっかりと理解しよう。
詳細
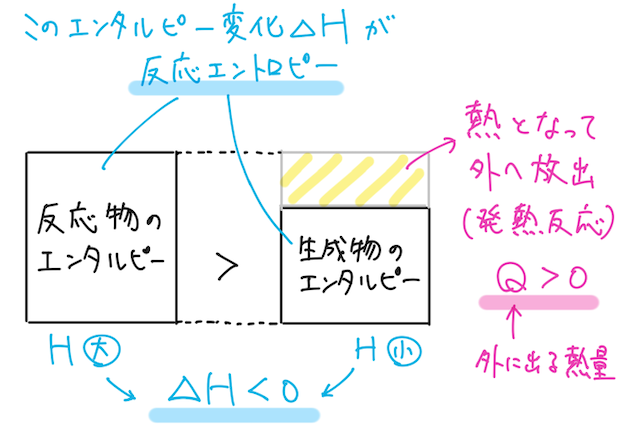
ここで、一定圧力のもとで、反応のときに系(物質のグループ)が放出・吸収する熱量のことを反応エンタルピーという。
上で見たように、反応で放出・吸収する熱量は、反応前後のエンタルピーの差にあたるので、反応エンタルピーは、生成物が持つエンタルピーから反応物が持つエンタルピーを引いて、エンタルピー変化
※ 変化量を求めるときの鉄則:「後」-「前」!
よって、この符号が負であれば、反応後の生成物の方がエンタルピー(つまりエネルギー)が小さくなるので、系は熱を放出しており発熱反応であるとわかる。
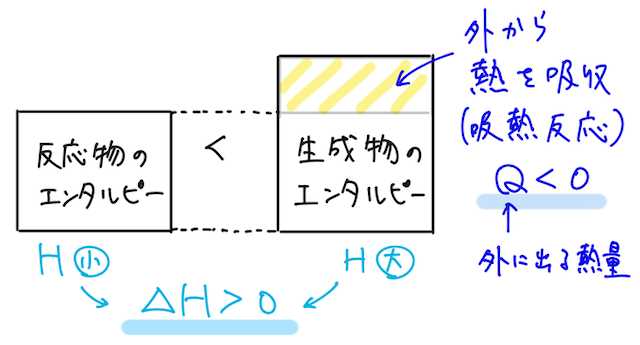
一方で、この符号が正であれば、反応後の生成物の方がエンタルピー(つまりエネルギー)が大きくなるので、系は熱を吸収しており、吸熱反応であるとわかる。
反応エンタルピーの種類
反応エンタルピー(
- 燃焼エンタルピー:物質
が完全燃焼するときの反応エンタルピー - 生成エンタルピー:化合物
が、その成分元素の単体から生成するときの反応エンタルピー - 溶解エンタルピー:溶質
が、多量の溶媒に溶解するときの反応エンタルピー - 中和エンタルピー:酸と塩基の中和反応によって
の水ができるときの反応エンタルピー - 融解エンタルピー:物質
が、固体から液体に状態変化(融解)するときの反応エンタルピー - 蒸発エンタルピー:物質
が、液体から気体に状態変化(蒸発)するときの反応エンタルピー - 昇華エンタルピー:物質
が、固体から気体に状態変化(昇華)するときの反応エンタルピー
補足
上で見たように、系自体のエネルギーの変化を表す反応エンタルピーの符号と、実際に熱が出たかどうかで考えたときの符号がひっくり返るのでややこしい。
系は発熱している 系は吸熱している
しかし、根拠をしっかり理解しておけば何も怖くない!
この用語を含むファイル
関連動画





関連用語